| 王洁, 内科学博士, 肿瘤学博士后。 北京医科大学临床肿瘤学院& 北京肿瘤医院主任医师、教授、胸部肿瘤内科主任, 博士研究生导师。中国抗癌协会肺癌专业委员会常委, 中国抗癌协会临床肿瘤学协作中心执行委员, 北京医学会肿瘤专业委员会委员, 中国抗癌协会临床肿瘤学协作中心肉瘤专家委员会副主任委员, 中华结核与呼吸杂志、中国肺癌杂志、Clin Lung Cancer编委。 十多年来一直致力于肺癌规范化、个体化多学科综合治疗及相关研究。在转化研究方面围绕多药耐药, 从组织及外周血探寻能预测分子靶向治疗和化疗疗效、预后的分子标志, 部分研究成果已应用于临床实践。作为课题负责人多次承担国家自然科学基金、国家863科技支撑项目、北京市首发基金等研究。在国内外肿瘤学核心期刊J Clin Oncol、Cancer Res、Clin Cancer Res等杂志上发表论文80余篇。参编专著3部。2010获得国家杰出青年科学基金资助。荣获第七届中国青年女科学家奖。 |
Makoto M, Akira I, Kunihiko K, et al. Gefitinib or chemotherapy for non-small cell lung cancer with mutated EGFR [J]. N Engl J Med, 2010, 362(25): 2380-2388.
2b。
• 晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者采用传统细胞毒药物化疗有效, 但同时会伴随严重不良反应的发生, 如脱发、血液恶性疾病和神经毒性等。
• 表皮生长因子受体(epidermal growth factor receptor, EGFR)酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)吉非替尼对亚裔、非吸烟、EGFR敏感突变的女性腺癌患者有较好疗效, 但可引起皮疹、腹泻和转氨酶升高等不良反应。
• 吉非替尼的疗效与安全性是否优于标准化疗方案目前尚不清楚。
比较吉非替尼与标准化疗用于治疗EGFR敏感突变的晚期NSCLC患者疗效与安全性的差异。
• 研究条件:日本东北大学医院、宫城肿瘤中心、日本东北大学医学研究所、埼玉医科大学国际医学中心、北海道大学医学研究所、日本东北研究协作组等日本的43家研究机构联合进行研究。
• 研究方法:多中心、随机、Ⅲ 期临床试验。
• 研究时间:2006年3月至2009年5月。
• 研究对象 :EGFR敏感突变的晚期NSCLC患者, 年龄≤ 75岁, 无EGFR T790M耐药突变, 并且从未接受过化疗。
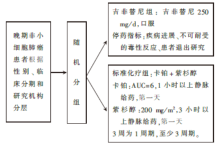
• 干预措施:见图1。
• 评价指标 :主要终点指标为无进展生存期(progression-free survival, PFS)。次要终点指标包括总生存期(overall survival, OS)、有效率(response rate, RR)和毒性反应。
• 吉非替尼组的PFS、中位PFS显著长于标准化疗组(10.4个月 vs. 5.5个月, 10.8个月vs. 5.4个月, 风险比分别为0.36和0.3, P值均﹤0.001), 客观有效率为73.7% vs. 30.7% (P< 0.001); 吉非替尼组的中位OS为30.5个月, 标准化疗组为23.6个月, 两组间差异无统计学意义(P=0.31)。
• 在吉非替尼组, 71.1%的患者发生皮疹, 55.3%转氨酶升高, 5.3%的患者发生间质性肺病。化疗组常见的不良反应为中性粒细胞减少症(77.0%)、贫血(64.6%)、食欲减退(56.5%)和感觉神经病(54.9%)。化疗组的毒性反应远高于吉非替尼组(71.7% vs. 41.2%, P< 0.001)。
• 与标准化疗相比, EGFR敏感突变的晚期NSCLC患者采用吉非替尼一线治疗可以明显延长PFS。
• 吉非替尼的毒性低于标准化疗, 患者可耐受。
表皮生长因子受体酪氨酸激酶抑制剂在晚期非小细胞肺癌中的应用, 虽仅短暂数年, 但如横空出世的黑马, 一经问世即显示出强大的生命力和活力, 与已有半个多世纪历史的传统化疗并驾齐驱, 代表着晚期肺癌两种迥然相异、但又具千丝万缕联系的治疗模式。
纵观EGFR-TKI的临床研究轨迹, 折射出靶向药物从临床非选择性(如BR21、ISEAL、INTEREST等)到选择性(IPASS、First-SIGNAL等), 并最终进入分子标志物选择(NEJ002、WJTOG3405、OPTIMAL等)的个体化治疗的必然发展历程[1, 2, 3, 4, 5, 6, 7, 8]。而其中来自日本的NEJ002研究是第一组基于前瞻性EGFR突变筛选的Ⅲ 期随机临床研究, 在基因分型的个体化EGFR-TKI治疗史上必将留下深深的痕迹。
该研究预计入组320例EGFR突变的晚期初治非小细胞肺癌患者, 随机接受吉非替尼或标准紫杉醇与卡铂一线化疗。其主要研究终点为PFS。但在对200例入组患者的中期分析中, 吉非替尼治疗组PFS的优势已尘埃落定, 故该研究提前结束。结果显示在EGFR突变的患者中吉非替尼治疗组较标准化疗组PFS显著改善(风险比0.36, 95%可信区间 0.25~0.51, P < 0.001), 有效率明显提高(73.7% vs. 30.7%, P < 0.001)。中位总生存时间吉非替尼治疗组具延长趋势(30.5个月vs. 23.6个月), 但差异未达到统计学意义 (P = 0.31)。
能否改善晚期肺癌的中位生存是评价一个新药疗效优劣的重要指标, 亦是临床抗肿瘤治疗追求的最高境界。目前有关EGFR突变者的治疗, 两大问题困扰临床医生。其一, 几组有关一线EGFR-TKI与标准化疗头对头比较的Ⅲ 期随机临床研究, 包括IPASS、 NEJ002、WJTOG3405等, 尽管吉非替尼治疗组PFS显著延长, 但OS的延长差异无统计学意义, 原因何在?众所周知, 后续治疗极大地影响OS, 试验组与对照组后续治疗的不均衡可能影响OS的结果。因此未来富有挑战性的研究应对两组所有的后续治疗进行限定, 使之均衡, 只有这样才具可比性, 获得真实的OS。但如此严格的临床研究在实践中很难进行。其二, 对EGFR突变患者, 什么是EGFR-TKI和化疗的理想治疗顺序?在NEJ002研究中, 一线化疗失败者94.6%接受吉非替尼治疗, 而一线吉非替尼治疗失败者67.5%交替至化疗组, 交替治疗的机率远远大于其它研究(IPASS组仅39%)。但尽管如此, 两治疗组的中位OS仍未达显著差异。有专家推测 EGFR突变者无论EGFR-TKI置于一线抑或二、三线, 总的中位生存时间应该相似, 因EGFR突变不仅是预测因素, 亦系预后因素。Rosell等[9]的SLCG研究显示EGFR突变者, 厄洛替尼一线治疗和二线治疗的PFS和中位OS相似, 似乎支持此种推测。但尚需一线及其后续交替治疗均设计严格的前瞻性临床研究证实。
该研究让人耳目一新又略感意外的是其入组标准不仅要求EGFR有敏感性突变, 且须无耐药性突变(T790M)。既往研究显示T790M、C-MET与继发耐药有关。但近期研究表明在未经EGFR-TKI治疗的组织标本中, 亦有低克隆的T790M、C-MET等耐药基因的变异[10, 11]。这些细胞克隆因对TKI的抵抗性在随后的治疗中被筛选和放大而导致耐药。故对EGFR-TKI的系列敏感与耐药基因而非单一基因进行同步检测, 将使个体化靶向治疗更加精准与丰满。尤其新近针对EGFR-TKI耐药的不可逆抑制剂已经进入Ⅱ /Ⅲ 期临床研究, 相信在不久的将来, 基于多基因分析的、作用机制不同的靶向药物的联合应用将为患者带来更大的受益。
EGFR突变作为EGFR-TKI最强有力的预测因子已经成为不争的事实。但临床实践中兼具高度的特异性与敏感性、快速简便且价格低廉的EGFR突变检测方法尚在探索中。经典的测序法能发现所有已知与未知突变, 但灵敏度低, 检测限为20%~30%; 笔者所在中心常用的DHPLC方法相对于DNA测序法, 所需时间短, 费用低, 灵敏度高(检测限3%~5%), 已知和未知突变均能检测, 但在未知突变检测方面需要一定的经验, 且需特殊的仪器设备; 而在IPASS等研究中大显身手的ARMS法, 因其具有高度的特异性和敏感性(检测限1%)而被推崇备至。但检测费用高限制了临床的使用。NEJ002研究应用核酸肽锁核酸(peptide nucleic acid-locked nucleic acid)的聚合酶链式反应检测EGFR基因已知位点的突变, 该法具有较高的特异性与灵敏度, 对检测组织的要求低, 细胞学标本亦能利用。但在层出不穷的方法中, 怎样标化和优化EGFR的突变检测, 是实现个体化EGFR-TKI治疗的基石。
原发瘤和转移病灶EGFR突变的异质性及其对EGFR-TKI治疗的影响有多大?化疗或辅助化疗是否部分改变EGFR突变状态?这些热点问题目前见仁见智、缺乏深度探索。日本的WJTOG3405研究因41.3%(71例)患者系术后复发转移, 其中59.2%(42例)具有辅助化疗历史, 而分子分析所用标本为复发转移前的手术标本, 有专家质疑此部分标本检测能否真实反映复发转移且化疗后的EGFR突变状态?[12]。NEJ002研究虽术后复发转移患者的比例低于WJTOG3405(仅17.6%), 异质性的潜在影响可能有限, 但在未来的临床研究中我们应尽可能利用复发转移或疾病进展后的即时标本进行基因检测以避免异质性可能的干扰。
毋容置疑, IPASS、NEJ002、OPTIMAL等研究的相继问世, 宣告肺癌个体化治疗的时代已经到来。未来更多靶向药物的临床研究将风起云涌。然看潮涨潮落, 大浪淘沙, 最终的胜者一定是那些有明确预测和预后分子标志的药物!
The authors have declared that no competing interests exist.
| 1 |
|
| 2 |
|
| 3 |
|
| 4 |
|
| 5 |
|
| 6 |
|
| 7 |
|
| 8 |
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
|