作者简介:吴一龙(1956-),男,广东汕头人,教授,博士研究生导师,主要研究方向为肺癌的多学科综合治疗及临床循证医学理论。E-mail: syylwu@live.cn
回眸21世纪头10年开篇肿瘤治疗学的大事件, 抗血管生成可算一个。
1971年美国学者Folkman提出了肿瘤血管生成的概念:只有刺激新生血管的形成, 恶性肿瘤才能生长和转移, 只要能阻断肿瘤新生血管的形成, 就能饿死肿瘤、治愈肿瘤。1983年Dvorak、1986年Ferrara发现了血管生成最重要的因子— — 血管内皮生长因子(vascular endothelial growth factor, VEGF)及其受体(vascular endothelial growth factor receptor, VEGFR); 1997年首次合成了针对VEGF的抗体— — 贝伐单抗。由此, 抗血管生成的恶性肿瘤治疗策略开始进入临床:2004年结直肠癌首战成功, 贝伐单抗提高了晚期结直肠癌30%的总生存(Hurwitz, et al. NEJM 2004); 2006年肺癌次仗获胜, 贝伐单抗提高了晚期肺癌19%的总生存(Sandler, et al. NEJM 2006)。国内也适时地推出了Endostar(恩度), 在肺癌的治疗上获得成功。一时间抗血管生成风头甚劲, 无出其右, 肿瘤科医生几乎到了言必谈抗血管生成的地步, 这种治疗方法也被不少人誉为“ 恶性肿瘤治疗的第四种方法” 。
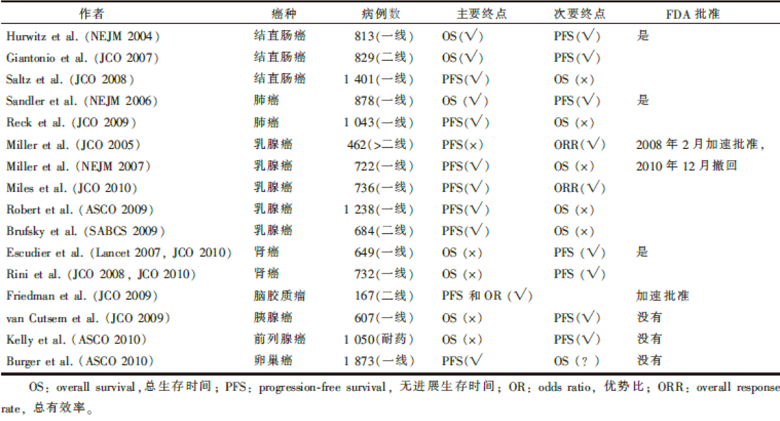
表1列出了贝伐单抗主要临床试验的结果。
| 表1 近年贝伐单抗主要临床试验的结果 |
从表1可看出, 贝伐单抗几乎可用于大部分的难治性癌症, 几乎所有的无进展生存时间都取得了有统计学意义的改善。但是, 本应是阳光明媚的春天, 却忽然倒下了一盆冷水。2010年12月16日, 美国食品药品监督管理局发出通知, 撤回贝伐单抗治疗HER2阴性乳腺癌的适应证。其理由非常简单, 贝伐单抗延长的无进展生存时间, 并不能转化成对乳腺癌的总生存获益, 同时有不可忽视的安全性问题。一时间舆论大哗, 美国国家卵巢癌联盟就对此表达了强烈的关注, 因为卵巢癌的临床试验结果非常类似于乳腺癌, 贝伐单抗治疗乳腺癌适应证的被拒, 是否会城门失火殃及池鱼呢?
当贝伐单抗对乳腺癌的适应证还在争论之时, 2011年1月份的美国《临床肿瘤学杂志》(JCO)[1], 在线扔出了一颗重磅炸弹:使用贝伐单抗的乳腺癌患者, 致死性心力衰竭发生率为1.6%, 而将安慰剂作为对照组的仅为0.4%, 死亡率整整高出了1.6倍。这份研究报告来自5个乳腺癌的临床试验, 囊括了3 700多例患者, 是第一份关于贝伐单抗和乳腺癌患者心力衰竭并发症相关的研究报告, 尽管1.6%的比例并不算高, 但请注意, 因为乳腺癌患者多数会使用蒽环类化疗药物和分子靶向药物曲妥珠单抗, 而这两种药也和乳腺癌患者的心脏病并发症相关, 因此, 贝伐单抗在乳腺癌使用上的心脏安全性就特别地引人注目了。
无独有偶, 著名杂志《美国医学会杂志》(JAMA)也来凑热闹, 2月份该杂志发表了一项Meta分析[2], 包括了16个临床试验10 217例患者, 含贝伐单抗治疗方案的致死性并发症发生率2.5%, 高于不含贝伐单抗方案的1.7%, 差异具有统计学意义(相对危险度1.46, 95%可信区间1.09~1.94, P=0.01)。最常见的致死性并发症为出血(23.5%), 其次为粒细胞减少(12.2%)和胃肠道穿孔(7.1%)。有意思的是, 这项研究发现, 致死性并发症的发生与合用的药物有关, 但和肿瘤类型或贝伐单抗的剂量无关。如果联合使用的药物为紫杉类或铂类的话, 危险提高了2倍多(相对危险度3.49, 95%可信区间1.82~6.66, P=0.004 5, 发生率 3.3% vs.1.0%)。
饱受诟病的还有贝伐单抗的价格问题[3]。许多专家指出, 在美国, 目前使用贝伐单抗的费用每年约为5万多美金, 如果加上联合用药和静脉用药的费用, 每年需花费10万美金, 这是政府或保险公司难于承受之重, 如果是患者自己付费呢?那简直就是“ 蜀道之难, 难以上青天” 了。让许多跨国制药巨头闻之色变的英国NICE机构, 用他们自己设计的一套复杂表格评价贝伐单抗在结直肠癌上的应用之后就指出, 贝伐单抗的成本效益不好, 20 800英镑的花费, 只能延长患者6周的生命。由此, 贝伐单抗仍不能在英国拿到治疗癌症的适应证。
套用一句流行的网络语言:这个季节抗血管生成有点烦。
是到了应该仔细评估抗血管生成在癌症治疗上真正作用的时候了。
还是先看看表1所列的临床试验结果。从该表可看出贝伐单抗治疗实体肿瘤的两个特点, 一是贝伐单抗几乎能延长所有癌症的无进展生存时间, 但大部分不能延长总生存时间; 二是在屈指可数的可延长总生存时间的肺癌和结直肠癌上, 不同的临床试验的结果不一致。延长PFS的前提, 是在和化疗药物一起诱导治疗之后, 必须持续地单药维持治疗, PFS与维持治疗的时间几乎相等, 甚至在进展之后, 继续使用贝伐单抗还能让患者获益[4]。而过早停用抗血管生成药物, 有可能诱发肿瘤进展更快。这可能与VEGF信号通路的生物学特点相关。抗血管生成的生物学效应是非常复杂的, 它可以是正反馈, 也可以是负反馈, 对VEGF信号通路的抑制会增加VEGF的表达, 一旦停止使用, 有可能出现反弹效应— — 更多的血管生成和肿瘤生长。而如果不停地用药, 代价是什么呢?是否如前所述, 大大增加了已知的或未知的致死性并发症呢?这样在临床上就面临着如何平衡用药时间的问题了, 而这样的问题, 恰恰是至今为止所有的临床试验所欠缺的问题, 结果的不确定可能与此有关。
不同的临床试验产生不同的互为矛盾的总生存时间结果, 一定程度上说明了并非所有的癌症患者都能从使用贝伐单抗上获益, 也就是说, 只有一部分患者能从抗血管生成中获益, 而另一部分患者却只能体会到致死性的并发症。非常遗憾的是, 至今, 我们仍然套用细胞毒的研究套路来研究应该有靶点的抗血管生成药物— — one fit all而不是one fit one。因此, 抗血管生成, 不管是在结直肠癌还是在肺癌, 疗效提高一小步之后就达到了平台, 而且因为合适人群的未知和只有少数人获益而导致不可避免的入组不平衡, 出现矛盾的结果也就不足为怪了。
在思考这篇小文的时候, 抗血管生成的另外两支部队— — 直接破坏血管内皮的药物(诺华ASA404)和VEGF小分子酪氨酸激酶抑制剂(阿斯利康Vandetanib和拜尔Sorafenib)均传来了在肺癌战场失利的消息。我们不禁要问:抗血管生成的治疗策略, 能如我们原来所期盼的那么好吗?
回到个体化医疗的本意:正确的药物在正确的时间以正确的剂量用于正确的患者。如是, 抗血管生成策略要取得战略的成功, 需回到寻找有效的疗效或毒性预测标志物上。如否, 抗血管生成, 也只不过如此而已。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|