作者简介: 李 旸(1984-),女,辽宁抚顺人,在读硕士研究生,以恶性淋巴瘤的治疗为主要研究方向。
目的 系统评价中国非霍奇金淋巴瘤患者接受利妥昔单抗联合CHOP方案化疗的疗效与安全性。方法 以“美罗华”、“利妥昔单抗”、“非霍奇金淋巴瘤”、“系统评价”、“meta分析”、“随机对照试验”为检索词,计算机检索中国期刊网全文数据库(1991-2010年)、中国生物医学文献数据库(1991-2010年)、维普数据库(1991-2010年)、万方数据库(1991-2010年),手工检索可纳入文献的参考文献及可以利用的综述,收集国内关于利妥昔单抗联合CHOP方案治疗非霍奇金淋巴瘤的随机对照临床试验,两名评价者独立依据纳入标准筛选文献,对纳入文献行方法学质量评价后提取数据,统计学分析采用RevMan4.2软件进行。结果 共纳入4个随机对照试验,包括218例患者。Meta分析结果显示,利妥昔单抗联合CHOP方案化疗与单用CHOP方案比较,其完全缓解率(相对危险度1.32,95%可信区间1.01~1.73)和总有效率(相对危险度1.22,95%可信区间1.04~1.44) 差异有统计学意义,主要的化疗相关不良反应(白细胞下降、血小板下降、恶心呕吐、肝损害)的发生率差异无统计学意义。结论 国内目前有限的证据表明,与单用CHOP方案相比,联合应用利妥昔单抗能提高中国非霍奇金淋巴瘤患者的完全缓解率和总有效率,同时并不增加治疗的不良反应。但由于纳入的研究样本量较小,随机试验的总体质量不高,以上结论尚有待于更多大样本、设计完善、实施良好的前瞻性随机双盲对照试验进一步证实。
Objective To assess the effectiveness and safety of Rituximab plus CHOP chemotherapy for treating non-Hodgkin lymphoma among Chinese people.Methods Using the words “Rituximab”, “non-hodgkin lymphoma”, “systematic review”, “meta-analysis”, “randomized controlled trial” as searching words, we searched CNKI(1991-2010), CBM(1991-2010), VIP(1991-2010) and WANGFANG(1991-2010) databases. We also hand searched the relevant references of included studies and review. Randomized controlled trials performed in China on rituximab plus CHOP chemotherapy for treating non-Hodgkin lymphoma were collected. Two reviewers independently screened trails,evaluated the quality of included trials and extracted data. The Cochrane Collaboration’s RevMan 4.2 software was used for statistical analysis. Results Four trails involving 218 patients were included.Results of meta-analyses showed that significant differences were found in the total effective rate (RR=1.22, 95%CI 1.04~1.44) and complete remission rate (RR=1.32, 95%CI 1.01~1.73), but not in the major chemotherapy-related adverse reactions (leukocytopenia,thrombocytopenia, nausea/vomiting, liver-damage) between rituximab plus CHOP and CHOP alone.Conclusion Based on the present domestic trails, compared with CHOP chemotherapy, treatment for non-Hodgkin lymphoma with Rituximab plus CHOP chemotherapy can improve the total effective rate and the complete remission rate and meanwhile it doesn’t increase the adverse reactions. However, because of the low quality and small sample of included RCTs, more large-sample, well-designed, exactly-performed, double-blind, randomized and controlled trials are still required.
非霍奇金淋巴瘤(non-Hodgkin lymphom, NHL)是淋巴造血系统恶性肿瘤。在我国, 其发病率在恶性肿瘤中上升最快, 是发病率最高的十大恶性肿瘤之一。根据淋巴瘤原发部位和疾病恶性程度的不同, 其治疗主要有手术切除、放疗、化疗和三者结合以及骨髓移植等方案。CHOP方案(环磷酰胺、长春新碱、阿霉素、强的松)一直是治疗大部分非霍奇金淋巴瘤亚型的一线化疗方案, 但其完全缓解率尚不足50%。1997年利妥昔单抗(Rituximab)被美国食品药品监督管理局(Food and Drug Administration, FDA)批准应用于临床。国外诸多文献报道, 利妥昔单抗联合不同化疗方案治疗不同病理亚型的NHL较单一化疗疗效显著, 体现在显著提高了疾病的缓解率、无进展生存期和总生存期。在国内, 由于经济条件等各方面因素的限制, 利妥昔单抗只是在近年才逐渐应用于中国人群, 且大多为个案报道, 少有利妥昔单抗联合化疗和单纯化疗疗效比较的临床随机对照试验(randomized controlled trial, RCT)。随着利妥昔单抗在临床应用越来越广泛, 为进一步确定该药物在中国人群中应用的疗效与安全性, 本研究对国内相关的临床随机对照试验进行系统评价, 为临床治疗提供循证依据。
①纳入对照组行CHOP方案化疗, 治疗组为利妥昔单抗联合CHOP方案(RCHOP)化疗的临床随机对照试验, 无论是否采用分配隐藏或盲法。
②研究对象为18~80岁经组织学检查证实为CD20+的B细胞非霍奇金淋巴瘤患者, 预计生存期超过6个月。
RCHOP方案与CHOP方案比较。
RCHOP方案:利妥昔单抗 375 mg/m2, d1; 利妥昔单抗应用后2天行CHOP方案化疗, CHOP方案同对照组。
CHOP方案:环磷酰胺750 mg/m2, d1; 阿霉素50 mg/m2, d1; 长春新碱1.4 mg/m2, d1; 强的松60 mg/d, d1~d5。
计算机检索中国期刊网全文数据库、中国生物医学文献数据库、中文科技期刊全文数据库、万方数据库。检索年限设为1991-2010年(利妥昔单抗1991年于IDEC制药公司实验室研制成功)。检索词为美罗华、利妥昔单抗、非霍奇金淋巴瘤、系统评价、Meta分析、随机对照试验。手工检索可纳入文献的参考文献。
由两名评价员对所有检索到文献的题目和摘要进行阅读, 排除重复和明显不符合纳入标准的文献, 获取初筛拟纳入文献的全文, 逐篇阅读全文, 最终确定纳入的文献, 如有分歧, 通过双方讨论解决或由第三者协助判断。
纳入的随机对照试验的方法学质量采用Cochrane Reviewer Handbook4.2.2随机对照试验的质量评价标准进行评价:根据随机方法、盲法、分配隐藏等标准评价纳入研究的质量。(1)随机方法:①随机方法充分, ②随机方法不清楚, ③随机方法不充分。(2)分配隐藏:①隐藏方法正确, ②隐藏方法不清楚, ③隐藏方法不充分, ④未采用隐藏方法。(3)盲法:①盲法恰当, ②盲法不清楚, ③盲法不恰当。(4)有无失访或退出, 若有失访或退出时, 原因是否描述清楚, 是否采用意向治疗分析。根据上述标准分别对4篇RCT给出Jadad质量评分。
由两名评价员独立提取, 交叉核对, 将得到的信息输入到计算机数据库中。提取的资料内容包括以下三方面。
①纳入研究的特征:第一作者, 发表年份, 发表期刊, 每个研究中两组病人的病例数, 男女比例, 中位年龄, 疾病分期, IPI评分, 所用药物的剂量、用法及疗程。
②纳入研究的质量评估:随机方法、分配隐藏方法、盲法与否、随访情况、是否使用意向治疗分析。
③结局指标:化疗结束时的完全缓解率、总有效率、不良反应发生情况。
纳入研究有足够相似性时, 采用Cochrane 协作网提供的RevMan4.2 软件进行Meta 分析, 否则采用描述性分析。当各研究间无统计学异质性时采用固定效应模型; 如各研究间存在统计学异质性时尽可能找出异质性来源, 如不存在临床或方法学异质性, 则采用随机效应模型进行合并分析。结果测量的度量衡单位相同的连续变量采用加权均数差(weighted mean difference, WMD)、分类变量采用相对危险度(risk ratio, RR)及其95%可信区间(confidence interval, CI)表示。
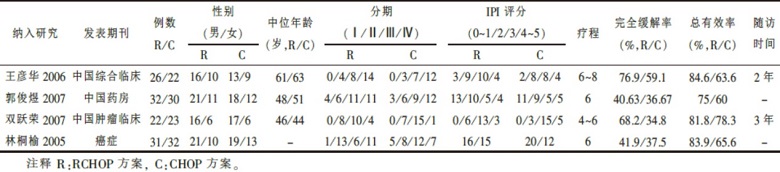
经过检索共查到相关文献198篇, 通过阅读摘要及查阅全文, 排除回顾性研究及非随机对照研究, 共搜集到4篇符合纳入标准的关于非霍奇金淋巴瘤接受利妥昔单抗联合化疗与单纯化疗疗效比较的随机对照文献[2, 3, 4, 5]。合计218例患者中, 治疗组111例, 对照组107例。各纳入研究的特征见表1。所有纳入研究的治疗组与对照组基线平行可比。
| 表1 纳入研究的特征 |
本研究纳入的4个RCT中, 均对患者的基线情况进行了报道, 均在文中提及了“ 随机” , 其中2篇RCT对随机方法进行了描述[2, 5], 2篇RCT对失访人数及失访原因进行了描述[4, 5], 所有文献均未对盲法、随机隐藏情况及治疗意向性分析进行报道。Jadad评分为1分的1篇, 2分的2篇, 3分的1篇, 具体见表2。
| 表2 纳入研究的质量评价 |
2.3.1 完全缓解率
4篇文章均对应用RCHOP和CHOP方案化疗后完全缓解的例数进行了统计, 研究结果间无统计学异质性(P=0.55), 故采用固定效应模型合并分析。结果显示:RCHOP组完全缓解率高于CHOP化疗组(55%vs.41%), 其差异有统计学意义(RR=1.32, 95%CI 1.00~1.74), 见图1。
2.3.2 总有效率
总有效率为完全缓解率与部分缓解率的总和, 4个研究分别对RCHOP和CHOP方案化疗后总有效人数进行了统计, 研究结果间无统计学异质性(P=0.7), 采用固定效应模型分析。分析结果为:RCHOP组总有效率高于CHOP组(81% vs.66%), 其差异有统计学意义(RR=1.22, 95%CI 1.04~1.44), 见图2。
2.3.3 不良反应
4个RCT均对药物不良反应进行了观察, 2篇研究按WHO抗癌药毒性反应评价标准进行了评价[3, 4], 1篇研究根据NCIC 常见毒性反应标准分级[5]。治疗组和对照组均有不良反应报道, 主要为:白细胞下降、血小板下降、恶心呕吐、肝损害、发热、寒战、黏膜炎、末梢神经炎、脱发等, 具体见表3。本文对RCHOP和CHOP组发生率前四位的不良反应[白细胞下降(RR=1.03, P=0.83)、血小板下降(RR=1.07, P=0.64)、恶心呕吐(RR=0.94, P=0.75), 肝损害(RR=0.89, P=0.64)]进行统计, 各不良反应发生率的差异均无统计学意义。1篇研究报道了在RCHOP治疗组出现6例与利妥昔单抗输注相关的副作用(寒战和发热), 程度较轻, 为Ⅰ 级或Ⅱ 级, 症状均在输注减慢或停止后消失[5]。该研究还报道了RCHOP组1例严重不良事件。该例患者( 原有慢性乙肝病史, 入组时非活动性)在第4个疗程开始前常规检查发现肝功能异常, 暂停治疗, 给予保肝治疗, 但患者最终仍因肝功能衰竭而导致死亡。
| 表3 利妥昔单抗联合CHOP方案化疗及单用CHOP方案化疗组的主要不良反应 |
利妥昔单抗于1991年研制成功, 于1997年被美国FDA批准上市, 是针对B 细胞CD20 抗原通过基因工程方法研制的一种人/鼠嵌合型单克隆抗体, CD20是非糖基化的Ⅲ 型跨膜蛋白, 表达在前B淋巴细胞的晚期和成熟B淋巴细胞, 而在造血干祖细胞和其它正常组织中无CD20抗原的表达。95%以上的B细胞淋巴瘤都有CD20抗原表达, 当与抗体结合后, CD20不会发生调变、内化或脱落, 因此CD20抗原是免疫治疗B 细胞淋巴瘤的理想靶点。利妥昔单抗驱B效应独特的作用机制为:①通过抗体依赖和补体介导的细胞毒作用杀伤CD20+的B淋巴细胞; ②诱导B淋巴细胞相关的恶性肿瘤细胞凋亡; ③增强耐药细胞株对化疗药物的敏感性; ④下调bcl-2基因表达[6, 7]。利妥昔单抗(美罗华)上市十余年来, 国外学者就其单药治疗和与化疗药物联合治疗的疗效进行了多项临床研究。Coiffier等[8]通过随机对照的方法在399例老年弥漫大B细胞淋巴瘤患者中比较了CHOP和RCHOP方案的疗效, 得到的结论是加用利妥昔单抗较单纯CHOP方案治疗提高了完全缓解率, 降低了治疗失败和复发的可能, 延长了无病生存期和总生存期。Pfreundschuh等[9]的研究表明利妥昔单抗联合类CHOP 方案治疗初治年轻低危弥漫大B细胞淋巴瘤有生存益处。
流行病学资料显示, 中国人群的淋巴瘤构成和欧美国家有很大差别。利妥昔单抗在近几年才开始在国内得到广泛应用, 并逐渐有医疗机构对其与化疗药物联合应用开展了随机对照临床试验。本系统评价以4~8个疗程化疗后疾病的完全缓解率和总有效率为观察指标, 并对化疗药物不良反应进行了统计。结论为利妥昔单抗联合CHOP方案化疗较单纯CHOP方案能提高CD20+的NHL的完全缓解率和总有效率, 同时未见药物不良反应增加。由此得出利妥昔单抗治疗中国人群的NHL同样具有疗效优势。本研究纳入的4个RCT中有1篇为多中心的前瞻性随机对照试验, 为高质量研究, 其余3篇Jadad评分均< 3分, 为低质量研究。各研究均对基线进行了详细描述, 治疗组与对照组之间平行可比, 有2篇文章提到了随机分配的方法, 另有2篇文章对失访人数及失访原因进行了描述, 所有文献均未对盲法、随机隐藏情况及治疗意向性分析进行报道, 全部文献均未进行成本效益分析。由于阳性结果更容易发表, 纳入的研究可能存在发表偏倚, 且本Meta分析未纳入国外发表的相关文献, 总体纳入样本量较小, 研究质量不高, 可能使本研究的结论受到一定的局限。近年的研究表明, 利妥昔单抗联合不同化疗方案对不同病理亚型的淋巴瘤治疗效果不尽相同, 因此有必要开展大样本、高质量的前瞻性随机双盲临床试验, 并按照不同病理类型和不同化疗方案进行亚组分析, 对各病例进行足够长时间的随访, 为利妥昔单抗治疗NHL在循证医学上提供充分而有力的论证。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|