作者简介: 田 珍(1984-),湖北荆门人,在读硕士研究生,主要研究方向为消化道肿瘤。
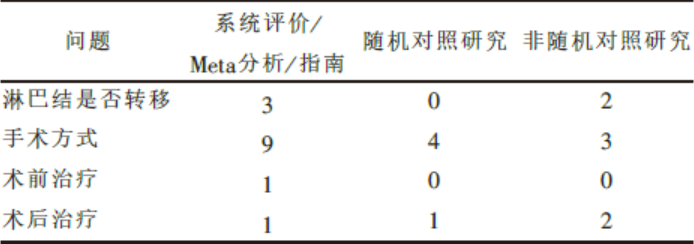
目的 借助循证医学的方法为1例早期胃癌患者确定治疗目标及治疗方案。方法 在充分评估患者情况后,提出临床问题,从Cochrane图书馆(网络版2000-2009年)、PubMed和EMBASE(2000-2009年)上进行检索。检索的主题词为: stomach cancer, early cancer, therapy, preoperative treatment, postoperative treatment, lymph node metastasis, invasive therapeutic technique, postoperative complication, postoperative hemorrhage, meta analysis, systematic review, randomized controlled trial (RCT), practice guideline。结果 共检出与不同问题相关的指南、系统评价或Meta分析14篇,随机对照试验5篇,非随机对照研究7篇。通过对检索结果进行分析,结合患者意愿,为患者制定了合理的治疗方案。结论 采用循证治疗的方法,为1位诊断为早期胃癌患者确定合理的治疗方案,可以有效提高治疗效果,提高患者生存质量。
Objective To formulate an evidence-based treatment plan for a patient with early gastric cancer.Methods Based on the clinical questions raised by a patient with early gastric cancer, we searched the Cochrane Library (online year 2000 to 2009), PubMed and EMBASE (year 2000 to 2009) for meta-analysis, systematic review, randomized controlled trial(RCT), guideline, case-control studies.Results We found 14 practice guidelines or systematic reviews or meta analysis, 5 RCT, and 7 case-control studies. After analyzing those papers and sought the opinion of the patient, we founded a proper treatment protocol for the patient.Conclusion Survival rate and therapeutic efficacy could be improved through evidence-based treatment.
胃癌是我国最常见的消化道恶性肿瘤之一, 在我国发病率和死亡率分别约为25/10万和21/10万。早期发现和治疗是改善预后的关键。早期胃癌(early gastric cancer, EGC)是指癌组织侵及胃黏膜层或黏膜下层, 而不管肿瘤大小及是否有淋巴结转移, 分为黏膜内癌和黏膜下癌。既往胃癌发现时往往为中晚期, 随着内镜设备及各项技术的不断更新, EGC的发现率正不断提高。现有的诊查手段使患者有可能在术前获得EGC病变的精确评价、淋巴结是否转移和TNM分期, 从而接受微创治疗达到相同或更佳的治疗效果。微创治疗包括腹腔镜辅助的胃切除、内镜下黏膜切除术、内镜黏膜下切割术、腹腔镜联合内镜治疗等。日本和西方学者在这方面作了很多研究, 但仍有部分学者特别是中国学者认为现有的术前评估虽有进步但仍欠严谨, 因此对此类限制性手术持怀疑态度。目前临床实际中, 面临越来越多的各有优缺点的可供选择的仪器设备、手术方式以及患者的期望值不断提高, EGC治疗方法的选择必须根据患者的年龄及肿瘤的位置、大小、数量、组织类型、浸润深度、淋巴结转移等情况综合考虑, 其中淋巴结是否转移是最关键的因素。为此, 我们对1例EGC患者应该选用哪种治疗方法进行了检索和评价, 以期待为其优选治疗方案提供帮助。
患者余某, 男, 68岁, 因“ 腹胀、腹痛半月” 入院治疗。既往无特殊病史。约半个月前开始无明显诱因出现阵发性腹胀、腹部隐痛不适, 排气、解便后及空腹时稍可缓解, 伴嗳气和吞咽困难。发病以来, 患者食欲不佳, 精神、睡眠一般, 体力体重略有下降。查体:患者生命体征平稳, 意识清楚, 精神尚可, 步入病房, 巩膜及皮肤无黄染, 浅表淋巴结未触及肿大, 心、肺(-), 腹部平软, 上腹压痛(+), 下腹压痛(-), 无反跳痛, 肝脾肋下未触及, Murphy征(-), 肝、肾叩击痛(-), 移动性浊音(-), 肠鸣音约5次/min, 余体征未见异常。血、尿常规正常, 肿瘤标志物CEA阳性(4.98 μ g/L), 大便潜血(-)。在电子胃镜检查中, 发现胃纵向下部有一处凹陷性溃疡, 周边水肿及充血明显, 约1.5× 1.5 cm, 质硬, 取少许病变组织活检, 病理示:高分化型管状腺癌。超声内镜提示:胃黏膜下癌。
根据我国胃癌诊治指南及患者内镜、病变组织活检结果, 该患者诊断为早期胃癌, 初步临床分期为T1N0M0。据此提出此患者的具体临床问题:①如何初步判断此早期胃癌患者是否有淋巴结转移?②此患者采取何种手术方式为最佳选择?淋巴结清扫的范围, 是局限性还是扩大化?③术前术后是否需要采取何种辅助治疗?肿瘤清除后是否行根除幽门螺杆菌(helicobacter pylori, Hp)的治疗?
文献检索资源:Cochrance图书馆(网络版2000-2009年)、PubMed和EMBASE(2000-2009年)上进行检索。
检索的主题词为:stomach cancer, early cancer, therapy, preoperative treatment, postope- rative treatment, lymph node metastasis, invasive therapeutic technique, postoperative complication, postoperative hemorrhage, meta analysis, systematic review, randomized controlled trial(RCT), practice guideline。
根据文献评价的基本原则对文献的真实性、重要性、实用性进行评价, 主要评价指标包括是否随机、随机方案是否隐藏、是否采用盲法及基线情况等。检索所获证据绝大部分为高质量的RCT及其系统评价或Meta分析。
发生淋巴结转移与否对患者预后及治疗方式的选择意义重大[1]。临床上可根据患者淋巴结是否转移及其转移情况, 尽量采用微创手术, 缩小切除范围, 提高患者的生存质量。有1篇系统评价表明局限在黏膜的胃癌有下列高危因素时高度暗示胃癌转移可能性:女性患者, 肿瘤在胃部较低位置, 肿瘤范围大, 低分化, 黏膜下浸润较深, 血管及血管内皮下浸润, 肿瘤血管内皮因子C阳性、肿瘤中增殖细胞核抗原表达超过25%标记指数[2]。还有另有1篇系统评价认为三维CT可以帮助在腹腔镜手术前评估胃癌患者是否有静脉血管侵犯情况[3]。根据Puli等[4]做的系统评价:超声内镜(endoscopic ultrasound, EUS)有助于胃癌TNM分期, 尤其是进展期胃癌的分期。
6.2.1 手术方式选择
检索结果中有腹腔镜辅助的胃癌切除术与开放性手术的比较, 也有内镜下黏膜切除术(endoscopic mucosal resection, EMR)与内镜黏膜下切割术(endoscopic mucosal resection and submucosal dissection, ESD)的比较, 但是没有EMR及ESD与开放性手术的比较, 也没有腹腔镜辅助的胃癌切除术与EMR及ESD的比较。有一些Meta分析、系统评价及RCT显示对于早期胃癌, 腹腔镜辅助的胃癌切除术创伤小, 可以大大减少进行外科手术时的血液丢失, 可以尽快恢复患者的胃肠道功能, 而淋巴结凊扫、患者的复发率、手术安全性与开放性手术基本一致, 短期效果高于开放性手术, 可以提高患者的生活质量, 但是会使手术时间延长, 且远期疗效未知[5]。1篇系统评价报道, EMR尽管是安全、微创且经济的治疗方法, 但是对于肿瘤范围大、肿瘤直径大于15 mm胃癌的浸润深度不能准确判断, 而且肿瘤复发的可能也会增加[6]。有文献报道ESD较EMR的适应证广, 手术切除的范围大, 有希望替代手术疗法, 但是它的出血、穿孔等并发症的机率较EMR高[7]。
6.2.2 淋巴结清扫的方式及其清扫范围
在Abe等[8]的临床试验中, 5例不符合EMR标准的EGC行ESD联合腹腔镜淋巴结清扫, 根据原发肿瘤的位置和胃的淋巴引流来决定腹腔镜所要切除的淋巴结群, 结果显示病灶切除完整, 腹腔镜下平均切除淋巴结15枚, 无任何并发症, 随访未发现肿瘤再发。有1篇Cochrane Library评价结论为, 没有证据支持淋巴结扩大清扫会对早期胃癌患者的生存有益, 相反, 有证据显示可能会增加术后死亡率[9]。而Popiela等[10]通过对238例行胃切除手术的早期胃癌患者的回顾性研究认为:扩大淋巴结清除范围可能会对部分患者有利, 然而没有随机临床试验支持此方案。
临床上有部分人认为术前化疗联合手术癌组织切除可强化肿瘤治疗的效果。新辅助化疗(neoadjuvant chemotherapy, NAC)是一种外科手术前的化疗, 对于其是否确实能提高完全切除癌组织的机率和延长生存期, 是否该常规术前应用, 临床上尚没有一致性结论。有1篇Cochrane Library 系统评价经过大样本的RCT后建议:由于没有明确有力的证据证明新辅助化疗对于胃癌切除有效, 因此在获得进一步的RCT证据支持之前, 不应常规开展术前新辅助化疗[11]。
6.4.1 术后是否根除幽门螺杆菌
临床上有不少证据显示Hp对于胃癌的发生有重要的作用, 对于胃癌组织清除后是否应该根除Hp临床上有一些提议, 但是尚不在明确的常规治疗之列。Fuccio等[12]所做的Meta分析显示:根除Hp似乎可以降低胃癌发生的危险。但是这项Meta分析中的6篇文献中只有1项研究是在亚洲开展的, 且只有2项是双盲的。另有1篇RCT显示EMR术后的胃癌患者应该根除幽门螺杆菌以防止异时性胃癌的发生, 其研究中治疗组与对照组比较, 异时性胃癌发生的优势比为0.353(95%可信区间0.161~0.775, P=0.009)[13]。
6.4.2 术后是否综合治疗, 采取何种措施
对于EGC术后是否需要采取进一步辅助化疗或免疫治疗, 临床上尚无一致性意见。在数据库中对于EGC术后治疗方面的文献较少, 没有找到相关Meta分析或系统评价。外文期刊《Expert Review of Anticancer Therapy?》上有1篇综述显示有2项RCT研究的结果表明辅助化疗可能使胃癌术后患者获益, 但是这2项研究没有给出辅助化疗对于不同时期、不同范围胃癌患者的危险与获益的比值比[14]。Hosokawa等[15]通过对642名早期胃癌部分胃切除后的患者长达11年的跟踪随访后, 建议早期胃癌术后的患者尤其是肠型胃癌患者, 为防止残胃癌的发生应定期内镜监测性检查, 每隔2~3年应进行一次。
胃癌的临床指南正在发展之中, 根据最新的临床指南, 局限在黏膜下层表层的早期胃癌应给予EMR治疗[16]。但从目前数据库中检索到的证据中, 尚无明确的证据显示EMR、ESD、腹腔镜下手术、开腹手术中何者对早期胃癌患者的生存质量占绝对优势。患者为68岁高龄, 家属希望癌组织能完整切除, 根据以上证据结合患者的意愿, 我们制定了如下治疗方案:患者经CT结合EUS的结果决定手术方式, 若未发现远处淋巴结和血管转移, 完善相关术前检查后, 可行腹腔镜下毕Ⅱ 式远端胃切除术及D2淋巴结清扫, 术前术后不行放化疗。术后每2年进行定期随访, 内镜监测肿瘤是否复发或残胃癌的发生。
患者经CT及EUS未发现远处淋巴结和血管转移, 完善相关术前检查后, 行腹腔镜下毕Ⅱ 式远端胃切除术及D2淋巴结清扫, 术前术后不行放化疗, 术中未见淋巴结转移。手术成功, 手术时间历经293分钟, 患者术后恢复情况良好, 10天好转出现。2010 年5月随访, 患者无瘤生存, 患者对目前的治疗效果十分满意, 远期疗效我们还在进一步观察随访中。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|