| 季加孚, 教授、主任医师、博士生导师, 国内著名的消化道肿瘤外科学专家。现任北京大学临床肿瘤学院胃肠肿瘤外科主任、胃癌协作中心首席专家、教育部恶性肿瘤发病机制及转化重点实验室胃癌研究室主任、外科教研室主任。兼任中国抗癌协会胃癌专业委员会主任委员, 中华医学会外科学分会国际合作部主任、胃肠专业委员会副主任委员, CSCO肿瘤营养治疗专家委员会副主任委员, 中国医药生物技术协会组织生物样本库分会委员。美国外科学会(ACS)会员、亚洲外科学会(ASA)常委、国际外科医师暨胃肠道医师协会(IASGO)学术委员会委员、国际胃癌协会(IGCA)会员、欧洲临床营养与代谢学会(ESPEN)会员、欧洲IASGO学院外科学客座教授。担任《Digestive Surgery》、《Annals of Surgery》(中文)、《中华医学杂志》、《中华外科杂志》、《中华胃肠外科杂志》、《中国实用外科杂志》等期刊的编委。 |
Alakus H, Hö lscher AH, Grass G, et al.Extracapsular lymph node spread: A new prognostic factor in gastric cancer [J]. Cancer, 2010, 116(2):309-315.
2b。
大多数胃癌确诊时已至中晚期, 患者生存率较低。淋巴结转移是影响胃癌预后最重要的因素之一。日本的胃癌分期法(the Japanese classification of gastric carcinoma, JCGC)曾以转移淋巴结相对于原发病灶的定位进行分站, 1997年以后, 国际抗癌联盟(International Union Against Cancer, UICC)采用的TNM系统划分胃癌分期主要是根据转移淋巴结的数目(pN0, 0; pN1, 1-6; pN2, 7-15; pN3> 15)而非定位。不管是JCGC分期还是UICC分期, 两者均未考虑转移淋巴结自身的特性。尽管都知道原发癌灶侵犯胃壁的深度是评估胃癌预后不可或缺的因素之一, 却鲜有报道研究肿瘤浸润转移淋巴结膜外的程度对于胃癌预后的影响。
临床方面主要从事消化道肿瘤外科工作, 积极推广规范化手术治疗, 开拓国内胃癌新辅助化疗领域。研究方向主要以胃癌的临床综合治疗和分子机理为重点, 牵头国内外相关临床试验(国际胃癌CLASSIC研究、结肠癌MASCOT、ACCElox研究等), 作为项目负责人主持和参与消化道肿瘤临床及基础科研项目14项, 其中国际合作项目3项、国家级6项、省部级5项。先后承担了国家“ 十一五” 支撑计划、“ 十二五” 重大专项、国家“ 863” 项目、国家自然科学基金项目、北京市科委重大项目、北京大学人类疾病基因研究中心项目等多项重大课题的研究。与美国斯坦福大学合作研究胃癌特异基因表述谱, 同期建立并完善了规范化标本采集及管理的肿瘤组织标本库。 先后发表论文100余篇, 编写和编译学术著作8部。培养硕士、博士、博士后研究生40余人。曾获北京市科学技术进步三等奖、科技部优秀文奖、北京市总工会经济技术创新标兵、中国抗癌协会先进工作者。
通过寻找膜外淋巴结转移与临床病理指标的关系, 探讨膜外淋巴结转移的程度是否可以作为评估胃癌预后的因素。
• 研究条件:德国Cologue大学普外科、Visceral Surgery肿瘤外科。
• 研究时间:1996年5月至2005年1月。
• 研究方法:单中心、临床回顾性研究。
• 研究对象:1996年5月至2005年1月因原发性胃癌在Cologne大学接受外科手术治疗的159名患者[102名(64.2%)男性, 57名(35.8%)女性, 平均年龄65.5岁(32~87岁)], 其中142名(89.3%)患者行胃切除术加D2淋巴结清扫术, 17例(10.7%)行胃次全切除术加D2淋巴结清扫术。为消除因挑选患者可能造成的误差, 研究对象中有24名(15.1%)患者应用新辅助化疗, 在多变量统计分析中会相应包含和去除该组患者的数据。
• 干预措施:术中清除淋巴结进行病理检查。根据肿瘤分化程度, WHO、Lauren、Goseki和Ming分期系统进行观察分析。膜外淋巴结转移的定义是指侵袭性癌症至少侵犯淋巴结的膜内或膜外侵及淋巴结周围的脂肪组织。排除涉及周围神经或血管的情况, 侵袭性癌细胞迅速生长导致淋巴结形态无法辨认可视为有膜外淋巴结转移。如果淋巴结膜内确认有困难, 可应用假想的一条界线代表原先的膜内。根据淋巴结的性质, 患者可被分为如下3组:无淋巴结转移; 有淋巴结转移(pN+), 但无膜外淋巴结转移(P-); 有淋巴结转移(pN+), 且至少有一个淋巴结存在膜外淋巴结转移(P+)。
• 评价方法:临床病理因素用Kendall(tau)测试或者卡方检验, 生存率比较采用Kaplan-Meier法, 并作log-rank检验, Cox回归分析预后。
• 评价指标:膜外淋巴结转移的程度作为评估胃癌预后因素的准确性。
切除的淋巴结根据日本胃癌协会所定的条例分组。在5 315个淋巴结节中, 3 402个(64%)来自第一站淋巴结(1~6组), 1 913个来自第二站淋巴结(7~12组)。1 166个(21.9%)淋巴结被检出有转移, 其中909个(17.1%)取自第一站淋巴结, 257个(26.8%)来自第二站淋巴结, 334个(73.2%)源于第一站和122个(17.6%)源于第二站的淋巴结显示有淋巴结膜外转移。43名(27%)患者属于pN1, 25名(15.7%)患者属于pN2, 28名患者属于pN3, 63名(39.6%)患者无淋巴结转移。在96名有淋巴结转移的患者中, 57名(59.4%)患者伴有淋巴膜外转移, 其中12名(21.1%)患者仅有1处膜外淋巴结转移, 45名(78.9%)患者膜外淋巴结转移多于1处。
有淋巴结转移而无膜外淋巴结转移者(pN+P-, n=39), 仅8例(20.5%)有远处转移; 有淋巴结转移并伴有膜外淋巴结转移者(pN+P+, n=57), 有22例(38.6%)出现远处转移。可见出现膜外淋巴结转移与远处转移显著相关(P=0.48)。pN3期患者中有22例(78.6%)出现淋巴结膜外转移, pN1期患者中仅有16例(37.2%)出现淋巴结膜外转移, 可见淋巴结膜外转移与UICC分期显著相关(P=0.001)。
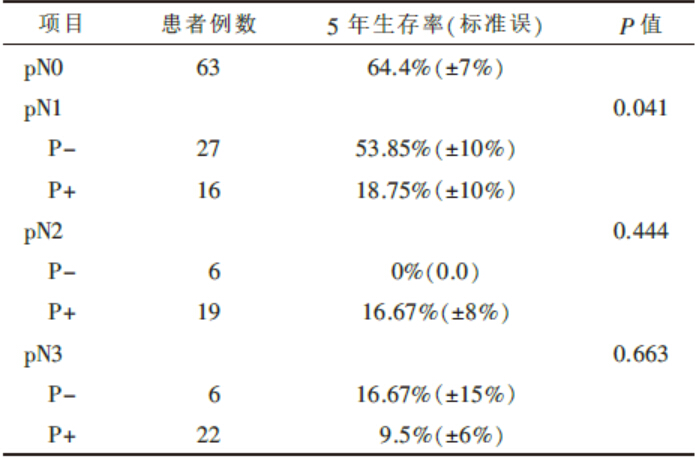
伴有膜外淋巴结转移的患者预后显著差于仅有膜内淋巴结转移的患者(P< 0.001); 伴膜外淋巴转移患者的5年生存率为13%, 伴淋巴结转移但无膜外结转移患者的5年生存率为39%, 无淋巴结转移患者的5年生存率为60%。另外, 基于pN分期和有无膜外转移分类, pN2组和pN3组患者的生存率并无明显差别。但在pN1组, 有膜外淋巴结转移患者的5年生存率仅为18.8%, 而无膜外转移患者的5年生存率为52.5%, 差异有统计学意义(P=0.041), 见表 1。
| 表1 根据UICC结合膜外淋巴结转移情况分组的生存率结果 |
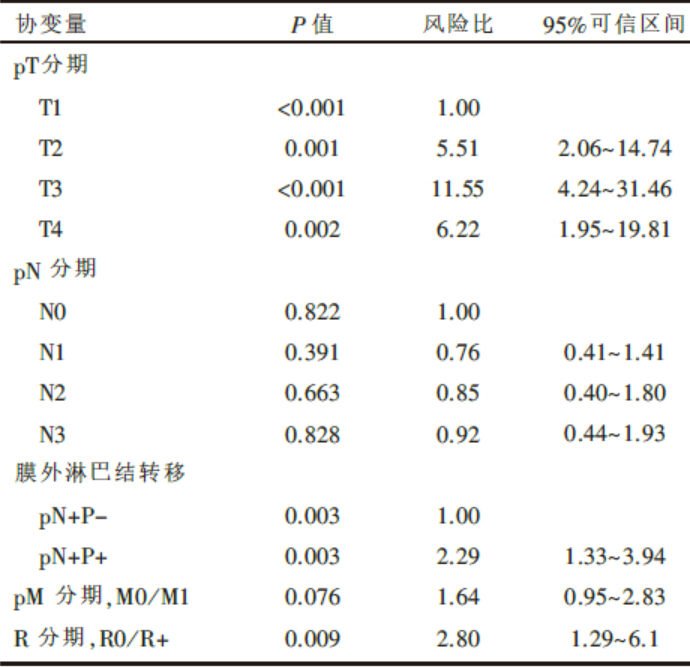
通过表2的数据可知, pT分期(P< 0.001)、R分期(P=0.009)以及膜外淋巴结转移(P=0.003)具有评估胃癌预后的价值, 可以作为独立影响预后的因素。相比UICC的pN分期(P=0.822), 膜外淋巴结转移具有更高的评估预后的价值。
| 表2 胃癌患者预后因素的多变量分析(例数=159) |
淋巴结转移是评估胃癌预后最重要的因素之一, 目前UICC的pN分期系统仅仅依据转移淋巴结的数目而没有考虑转移淋巴结其自身的性质, 有一定的局限性。本研究的结果表明膜外淋巴结转移的情况与肿瘤分期有密切联系, 是评估胃癌预后的独立的负相关因素。它既为UICC pN分期提供了相应的补充信息, 也有助于预后较差病人的识别。在未来的临床病理分期系统中, 阳性淋巴结的数目以及膜外淋巴结转移的情况应同时列入考虑范畴。
淋巴结转移和肿瘤浸润胃壁深度是胃癌的主要预后因素并且是当前胃癌主流分期系统的主要内容。目前广泛应用的胃癌分期标准主要是日本胃癌分期委员会(AJCG)制定的以淋巴结转移位置为依据的分期系统和国际抗癌联盟(UICC)制定的以淋巴结转移数目为标准的TNM分期系统。
日本分期系统中的N分期是依据淋巴结的解剖位置来确定的, 可以指导术中淋巴结清扫, 减少N分期的偏倚。但由于胃周淋巴结分布区域复杂, 医生难于辨认每个淋巴结的准确位置, 故在实际应用中受到限制。TNM分期系统主要用于指导预后, 准确地反映了转移负担及预后情况。是判断胃癌预后更为合理的指标, 简单、客观, 重复性好, 易于推广应用。但该分期系统对术中淋巴结清扫无指导意义。这两大分期系统随着东西方胃癌基础临床研究进展和交流的增加不断更新版本, 并且在分期上出现统一趋势。
无论是日本分期系统还是TNM分期系统都有各自的局限性, 因此很多学者在研究淋巴结转移方面是否有更好的预后指标。德国Alakus等学者在《Cancer》杂志上发表了《Extracapsular lymph node spread:A new prognostic factor in gastric cancer》一文, 主要研究胃癌转移淋巴结外膜侵犯的预后价值和相关的临床病理因素。该研究内容来自胃癌临床分期应用中出现的问题, 研究结果有一定的临床应用和指导价值。研究对象有较好的均一性, 所有患者均行D2淋巴结清扫术, 清扫淋巴结数目≥ 15个/例, 减少了淋巴清扫数目的偏倚, 同时作者为进一步减少甚至消除病例选择偏倚, 纳入24例新辅助化疗患者, 并且在多因素统计分析时分别纳入和排除这部分患者的资料。在数据统计方面, 作者根据统计数据的类型选择恰当的统计方法。此外, 作者为保证数据的真实性和结果的可靠性, 特别在病理数据资料方面, 由2名有经验的病理医师完全负责病理分期, 并作出书面报告。因此, 可以说这是1项具有较高价值和可信度的临床研究, 这些研究设计思路和数据处理方法值得我们借鉴。
当然, 这项研究也存在不足之处。该研究样本量较小, 其代表性受到一定影响, 需要更大样本量的随机对照研究来进一步证实。关于淋巴结包膜侵犯的定义, 不同医院病理科医师采用的诊断标准不同, 有学者定义为癌细胞突破包膜并侵犯周围脂肪组织[1], 有些学者定义为切除淋巴结周围脂肪组织内发现癌细胞[2], 采用的诊断方法不同, 会明显影响研究结果。本文献作者在确定淋巴结包膜原来位置困难时, 用一条假想的线代表原包膜位置, 这样描述淋巴结侵犯程度会存在较大偏差。因此, 应该有一个规范的淋巴结包膜外侵犯的定义, 定义不同, 其结果对患者预后分析会有较大影响, 近期日本学者Nakamura 等[3]将淋巴结包膜外侵犯分为包膜破裂和无包膜破裂两组, 发现包膜破裂组有更差的5年生存率(P< 0.05)和更高的腹膜复发率 (P< 0.01)。此外, 不少文献报道多种实体肿瘤存在淋巴结微转移, 胃癌中也存在这种现象, 并且是预后的负相关因素[4, 5, 6], 淋巴结微转移用常规病理检查方法不能确诊, 必须通过连续切片并做免疫组化来诊断。日本学者Ishii等[7]研究35例胃癌患者资料, 共切除1 028枚淋巴结, 常规HE染色淋巴结均无转移, 通过连续切片并做免疫组化发现有4例(11%)患者, 6枚(0.58%)淋巴结发生微转移。因此, 即使有包膜侵犯或淋巴结周围脂肪组织内微小癌灶, 常规检查未必发现, 存在一定漏诊率。
另外, 该研究发现有包膜侵犯的转移淋巴结无明显的临床或病理标志, 作者也没有分析与包膜侵犯有关的免疫标志。因此, 应进一步寻找敏感、重复性好的包膜侵犯的病理和免疫指标, 使诊断更具有可操作性, 便于推广。研究结果显示淋巴结包膜侵犯仅在转移淋巴结数目≤ 6个(pN1)时有预后意义, 而在转移淋巴结数目> 6个时在预后方面无明显差异, 因此也降低了该指标对胃癌的预后指导价值。
综上分析, 淋巴结包膜侵犯指标在临床的实际应用中还有一段路要走, 在进一步深入研究的基础上, 外科医师应与病理科医师共同讨论制定淋巴结包膜侵犯的客观指标, 规范统一的诊断方法, 尽可能避免使用主观指标。诊断方法应当具有可重复性和可推广性。另外, 各单位病理诊断水平参差不齐, 很难推广应用和交流, 应对病理医师进行规范化培训。期望随着研究的深入, 该项指标能够真正运用于并切实指导临床实践, 给胃癌患者带来福音。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|