| 徐建明教授, 军事医学科学院307医院消化肿瘤内科主任。中国生物工程协会分子靶向药物治疗专业委员会副主任委员、北京抗癌协会理事、中国老年肿瘤专业委员会常委、中国临床肿瘤学会执行委员、国家食品药品监督管理局(SFDA)新药审评专家, 国际NCCN中国版指南《胃癌》、《结肠癌》、《直肠癌》和《胰腺癌》的专家组成员。 主要从事胃癌、结直肠癌、食管癌、肝癌和胰腺癌等消化系统肿瘤的内科治疗和研究。先后主持了国家自然科学基金、全军“ 十一五” 科技攻关课题以及首都医学发展基金重点课题等, 进行胃肠道肿瘤分子靶向治疗的临床和基础研究。担任《Colorectal Cancer Res》中文版、《中华肿瘤杂志》、《癌症》、《临床肿瘤学杂志》等杂志编委。近年来已在《Int J Cancer》、《Eur J Cancer 》等国内外肿瘤期刊发表论文80余篇, 参与编写专著2部。 |
Fareed KR, Al-Attar A, Soomro IN, et al. Tumour regression and ERCC1 nuclear protein expression predict clinical outcome in patients with gastro-oesophageal cancer treated with neoadjuvant chemotherapy[J]. Br J Cancer, 2010, 102(11):1600-1607.
1a。
胃食管肿瘤是一种常见的、高致命性疾病, 以铂类为基础的新辅助化疗是胃食管腺癌患者的标准治疗方案, 其有效率近40%。尽管铂类药物对癌症患者的疗效不断提高, 但是它的毒副作用和耐药性却限制了其在实体瘤中的使用。肿瘤缓解分级(tumour regression grade, TRG)共分为1~5级, 常作为接受新辅助化疗患者组织病理学反应和肿瘤缩小的评分标准。
回顾性分析TRG、DNA损伤与修复相关的5个主要基因(ERCC1、XPF、FANCD2、APEI、p53)表达与疾病相关的总生存的关系。
• 研究方法:多中心回顾性研究。
• 研究时间:2001-2008年。
• 研究对象:诺丁汉大学附属医院收治的共245例胃食管肿瘤患者。
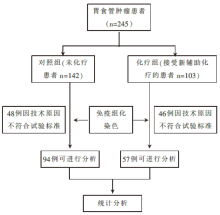
• 干预措施:流程图见图1。
• 评价指标:主要终点指标为总生存率(overall survival, OS), 次要终点指标为疾病相关生存率(disease-specific survival, DSS)和有效率(response rate, RR)。
共入组胃食管肿瘤患者245例, 入组病人分为2组:化疗组103例, 至少接受1疗程新辅助化疗; 对照组142例, 手术治疗后未接受化疗。随访结束时全组143例患者已经死亡(化疗组56例)。化疗组中, 96.4%患者接受2周期CF方案新辅助化疗, 78%接受3周期ECF/ECX方案。两组患者的基本资料及临床特点相似, 见表1。其中, 仅腺癌用来进行免疫组化染色和生存分析。
| 表1 胃食管肿瘤患者的临床特征 |
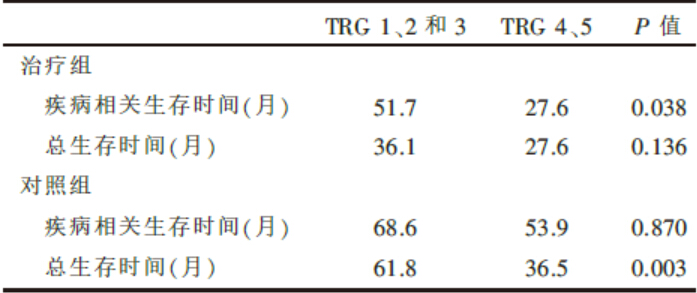
本研究显示接受新辅助化疗(化疗组)并获得满意效果患者(TRG 1、2或3)比无效者的疾病特异性生存时间明显延长; 对照组也如此, 见表2。
| 表2 治疗组和对照组疗效不同患者生存时间比较 |
本研究在两组(化疗组和对照组)分别选取数量不等标本进行ERCC1、XPF、FANCD2、APE1、p53 共5个基因核染色并进一步探讨其与临床病理的相关性。
结果表明, XPF和FANCD2与TRG及临床病理无相关性。在化疗组, APE1、ERCC1、p53的表达与T分级、淋巴结转移、血管神经侵袭等临床病理因素无关; APE1、ERCC1阳性患者其疾病相关生存时间较阴性患者明显缩短(P值分别为0.025和0.020); ERCC1阳性患者化疗无效(TRG 4、5), 总生存时间同样缩短(P=0.04)。在手术组, p53表达与淋巴结转移、神经侵袭密切相关(P值分别为0.016和0.023), p53核染色阳性率> 10%患者具有更短的疾病相关生存时间和总生存时间。
肿瘤缩小及免疫组化检测到的ERCC1核蛋白表达有望成为接受新辅助化疗的胃食管肿瘤患者的预后标志。
胃食管腺癌的术前新辅助化疗已经成为东西方国家普遍接受的治疗模式[1]。但是, 如何预测新辅助化疗的疗效, 是所有学者关心的问题。因为, 术前有效的患者, 预后好; 术前无效的患者, 可能因化疗耽误手术的时机, 患者的预后就差[2]。所以, 学者们关注的问题仍然是, 谁能从新辅助化疗中获益?
本文献截取两个不同时间段的患者, 一组是早期的单纯手术的患者, 另一组是新近接受ECF/ECX/CF术前新辅助化疗后再手术的患者, 回顾性分析肿瘤缓解分级(TRG)、DNA损伤与修复相关的5个主要基因(ERCC1、XPF、FANCD2、APEI、p53)的表达与疾病相关的生存和总生存的关系。结果认为TRG和ERCC1的表达对含铂的术前新辅助化疗疗效有预测作用。因为本研究是在化疗后, 通过术后肿瘤标本的分析, 来回顾性评价术前新辅助治疗的价值, 所以, 其实并不能把它们当作预测化疗疗效的标志, 而只能看做是评估化疗疗效的分子和病理标志。遗憾的是, 本文献没有提供接受新辅助化疗组的患者在化疗后, 根据RECIST标准评价临床有效和无效患者生存的差异, 以及TRG和ERCC1对患者生存的差异。因此, 很难说明这种分子和病理的疗效评价对临床疗效评价的补充价值究竟有多大。
最近, 有研究表明, 通过PET评价胃食管交界处癌化疗后, 肿瘤中葡萄糖摄取值的下降, 能够预测化疗的疗效。Lordick等定义肿瘤的葡萄糖标准摄取值(SUV)下降≥ 35%为有效, 他们在化疗2周时, 通过评价SUV值, 发现与化疗几个周期后的临床疗效评价具有很好的相关性。一项针对110例胃食管交界处腺癌的前瞻性的MUNICON研究进一步证实, PET对化疗后肿瘤初期代谢活性的评价能够预测化疗的疗效。他们的研究中, PET早期提示有效的患者占49%, 这些患者继续完成12周的化疗, 而PET提示无效的患者将终止化疗, 转而接受手术治疗。结果PET提示有效患者的中位无事件生存期是29.7个月, 明显长于无效患者的14.1个月[3]。与本文献的研究相比较, PET评价的花费可能会更大, 但体现对化疗疗效预测的价值似乎更大。
当然, 本研究的结论是值得以后的临床研究参考和借鉴的。尤其是对术后辅助治疗方案的选择, 具有重要的意义。因为, 新辅助化疗有效的患者, 术后辅助治疗可以维持原方案, 而无效患者可能就要更改辅助治疗的方案。为此, 以后的研究, 需要进一步关注TRG和ERCC1对含铂方案的疗效预测、临床按RECIST评估的疗效对患者生存的差异。只有提供这样的数据, 才能真正说明本研究的分子和病理的疗效评价对术前新辅助疗效判断的价值。
本文值得我们关注的是, 对于未接受新辅助化疗的患者, 研究者在术后TGR评估中, 提出的“ 自发缓解” 概念。这种没有经过化疗而达到“ 部分缓解” 的患者, 预后明显较好的原因, 是否与研究者推测的淋巴细胞的浸润引起宿主的免疫反应、或者是溃疡的黏膜层肿瘤的“ 自愈” 有关, 还值得进一步的研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|