| 巴一, 天津医科大学附属肿瘤医院消化内科主任, 教授, 主任医师, 博士研究生导师。专业方向为消化系统肿瘤的综合治疗。近年来参与国内外多个消化系统肿瘤治疗的多中心临床试验, 探讨消化系统肿瘤的综合治疗问题。现为中国医师协会肿瘤医师分会第一届委员会副会长, 中国抗癌协会学术部副部长, 胃癌专业委员会常务委员, 食管癌专业委员会常务委员, CSCO委员兼秘书。NCCN中国版结肠癌指南专家组成员, NCCN中国版直肠癌指南专家组成员。 |
Ajani JA, Rodriguez W, Bodoky G, et al. Multicenter phase Ⅲ comparison of Cisplatin/S-1 with Cisplatin/Infusional Fluorouracil in advanced gastric or gastroesophageal adenocarcinoma study: The FLAGS trial [J]. J Clin Oncol, 2010, 28(9):1547-1553.
1b。
胃癌在亚洲、南美洲、东欧、前苏联等地区发病率较高, 全世界每年有超过80万新发病例, 死亡率居第二位。除日本、韩国外很少地区施行胃癌的早期普查, 故大部分胃癌患者确诊时已是晚期。转移性胃癌是不可治愈的, 并且治疗的进展也很少, 到目前为止只完成了少数几个可改善预后的临床研究, 其中顺铂(DDP)和氟尿嘧啶类药物的联合是治疗晚期胃癌的Ⅲ 期临床研究中最常用的方案, 并且大多数研究机构推荐顺铂联合5-FU的方案作为基础方案与新的治疗方案进行对比研究。然而此联合方案副作用较大并且应用不方便, SPIRITS研究显示顺铂联合S-1治疗胃癌的疗效优于单药S-1, 而在晚期胃癌的治疗中急需寻找到一种与以往的方案相比有效率更高、安全性更好的治疗方案。
研究S-1联合顺铂方案治疗晚期胃癌疗效是否优于5-FU联合顺铂方案, 并进行安全性分析。
• 研究条件:包括美国、东欧、西欧、南美洲、澳大利亚、前苏联地区等共24个国家的146个研究中心参加, 非亚洲的一项全球的Ⅲ 期临床研究。
• 研究起止时间:2005年5月18日至2007年3月7日。
• 研究方法:多中心、前瞻性随机对照研究。
• 研究对象:晚期胃或食管胃结合部腺癌患者。
入选标准:既往未接受过化疗; 不能手术切除、局部晚期或转移性的胃或食管胃结合部腺癌; 有可测量或可评价病灶; 能够口服药物; 年龄≥ 18岁; ECOG PS评分0~1分; 足够的肝肾功能和骨髓功能。
排除标准:有严重的合并症可能会影响到方案的实施或依从性。
• 干预措施:试验组接受S-1联合顺铂方案治疗:S-1每日50 mg/m2, 分2次口服, 连续21天; 顺铂75 mg/m2, 静脉滴注1~3小时, 每28天重复。对照组接受5-FU联合顺铂方案治疗:每日5-FU 1 000 mg/m2, 持续静脉灌注24小时, 连续5天, 顺铂100 mg/m2静脉滴注1~3小时, 每28天重复。入组总病例数1 053例, 试验组527例, 对照组526例。试验组有4.4%的病例违反临床研究规则, 对照组有6.3%。
• 评价指标:主要终点指标为试验组的总生存期是否优于对照组; 次要终点指标为有效率、无进展生存期、治疗失败时间、安全性等。
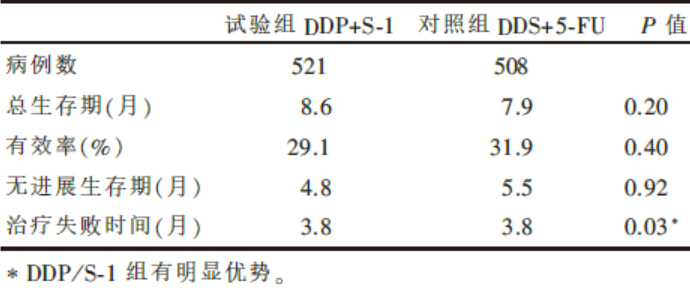
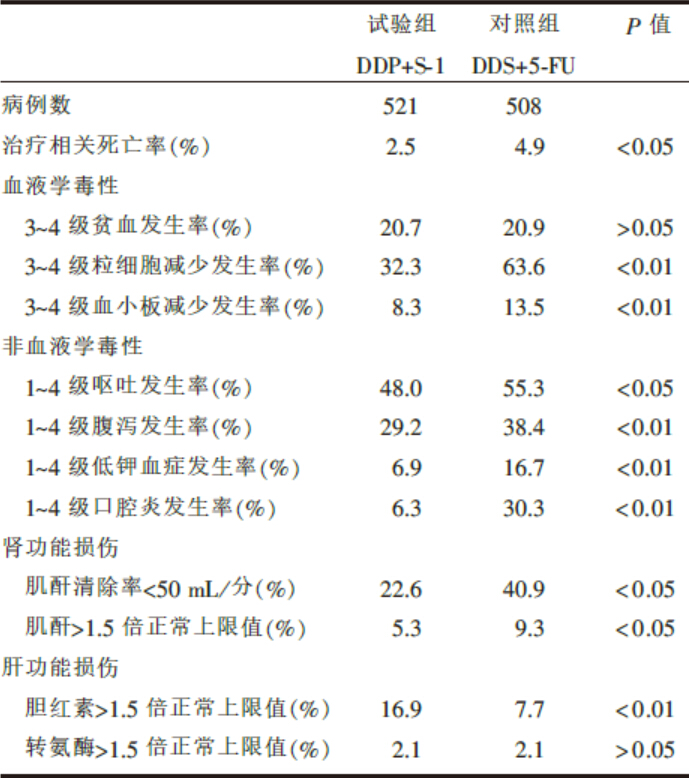
S-1联合顺铂治疗晚期胃或食管胃结合部腺癌与5-FU/DDP方案相比, 总生存期、有效率、无进展生存期等指标见表1; 安全性方面包括血液学毒性、非血液学毒性等的发生率见表2。
| 表1 S-1或5-FU联合顺铂治疗晚期胃癌的疗效 |
| 表2 S-1或5-FU联合顺铂治疗晚期胃癌的安全性 |
S-1联合顺铂治疗晚期胃或食管胃结合部腺癌与5-FU/顺铂方案相比并未显示出生存优势, 但是安全性有显著的提高。
S-1是第四代的口服氟尿嘧啶类的化疗药物。1999年在日本批准上市。在日本开展的临床研究已验证了该药物在东方胃癌人群中的疗效和安全性。目前在日本、韩国、新加坡和中国用来治疗进展期胃癌, 在日本和韩国亦用于根治性切除术后的胃癌的辅助治疗[1]。S-1是复合制剂, 由替加氟/吉美嘧啶/奥替拉西钾按1.0∶ 0.4∶ 1.0的摩尔比组成。吉美嘧啶用来延长氟尿嘧啶的半衰期, 奥替拉西钾用以改善胃肠道的耐受性。
SPIRITS研究的结果提示S-1联合顺铂对比S-1单药在东方人群里存在生存获益[2]。由于S-1在不同人种中代谢率差异较大, 为此Ajani进行了在西方人群里S-1联合顺铂的最大耐受剂量的Ⅰ 期研究[3]。随后在西方人群中的Ⅱ 期研究的结果同样令人鼓舞[4], 因此FLAGS研究是为了验证在非亚洲人群里, S-1/DDP对比5-FU/DDP能改善生存, 并能增加安全性和便利性。最后的研究结果并未达到预期终点, 没有带来优效性的结果, 但安全性是有优势的。
从试验的基础及设计而言, 这是一个设计比较合理的多中心大样本量随机对照研究。两组入选患者的临床特征是均衡的, 脱落率低, 97.7%的患者进入了最终分析, 样本量的估计按照医学统计学原理计算, 试验过程严格按照试验设计进行观察, 方案违背率很低, 因此该研究的结果是真实可靠的。
该研究采用的是优效性检验, 由于口服氟尿嘧啶类药物在非劣效检验中结果良好(如卡培他滨的REAL-2研究[5]), 因此美国FDA要求FLAGS研究必须为优效性检验才能使S-1在晚期胃癌一线治疗中获批。针对阴性的结果, 研究者并无明确的解释。对于顺铂在试验组使用100 mg/m2是否会延长试验组的总生存期, 或是在对照组顺铂剂量降至试验组水平是否会有总生存期差异的统计学意义, 这些问题都无法解答。当初研究者设计时给予两组不同的顺铂剂量, 且S-1的剂量低于东方人群常用的剂量水平, 并且为了匹配两组的治疗时间, 将S-1的口服周期改为连续3周停1周, 这些都有可能是导致最后结果阴性的原因。
从安全性方面而言, 试验组的血液学毒性、黏膜炎、电解质紊乱及肾毒性均较对照组差异有统计学意义, 可能与试验组的顺铂剂量偏低相关。而肝毒性有所增加, 可能与S-1本身的机制相关。可能因为S-1中的替加氟主要在肝脏内活化形成5-FU, 而吉美嘧啶为二氢嘧啶脱氢酶(DPD)抑制剂, 减少了5-FU灭活, 从而导致在肝脏蓄积而引起毒性, 但确切机制有待研究。
尽管FLAGS研究未获得预期的结果, 但S-1/DDP联合方案在严重不良反应和治疗相关性死亡方面明显下降, 不失为晚期初治的胃癌患者的一个备选治疗方案。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|