| 王永胜, 男, 医学博士, 研究员, 山东省肿瘤医院乳腺病中心主任, 肿瘤学硕士研究生导师, 中国抗癌协会乳腺癌专业委员会常委、中华医学会肿瘤学分会乳腺癌学组委员、NCCN乳腺癌指南中国版修订专家组成员, 山东省医药卫生重点学科、山东省乳腺病防治中心(山东省卫生厅)及山东省乳腺病诊断治疗技术研究推广中心(山东省科技厅)学术带头人, 山东省优秀创新团队核心成员。在国内率先开展乳腺癌前哨淋巴结活检替代腋淋巴结清扫术的多中心系列研究、乳腺癌保乳微创治疗等研究, 为主或为首参与的 “ 功能影像学技术引导的肿瘤放射治疗” 、“ 乳腺癌保留乳房治疗系列研究” 、“ 腋淋巴结阴性乳腺癌预后指标及治疗对策” 等课题研究先后获得国家科技进步二等奖1项、山东省科技进步一等奖1项、三等奖3项, 主译《乳腺病学》、主编《乳腺癌保微创治疗学》、参编著作10部, 第一作者或通讯作者发表论文100余篇, 其中SCI收录论文/摘要24篇。1998年1月至1999年1月作为高级访问学者赴英国威尔士大学医院外科研修1年。中华乳腺病杂志、中华内分泌外科杂志、肿瘤研究与临床、中国普外基础与临床、中国肿瘤外科杂志、实用医院临床杂志编委, 中国肿瘤临床特约审稿专家。 |
Ansari B, Ogston SA, Purdie CA, et al. Meta-analysis of sentinel node biopsy in ductal carcinoma in situ of the breast [J]. Br J Surg, 2008, 95:547-554.
1a。
在手术前诊断乳腺导管原位癌(ductal carcinoma in situ, DCIS)的患者是否应行前哨淋巴结活检(sentinel lymph node biopsy, SLNB)目前仍有争议。目前支持者和反对者的观点都是出自于一些小样本研究, 本文献采用Meta分析的方法分析了DCIS患者中前哨淋巴结转移的发生率相关的文章和报告。
确定术前诊断的乳腺导管原位癌患者是否应行前哨淋巴结活检。
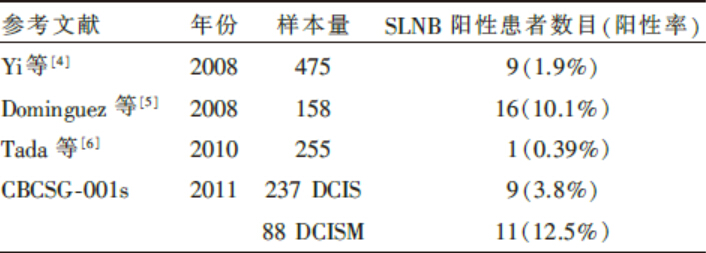
| 表1 术后病理诊断为DCIS患者的SLNB阳性率 |
• 研究方法:Meta分析。
• 检索方法:在电子医学数据库MEDLINE、EMBASE、CINHAL、Ovid及Cochrane Library中进行检索(直到2007年8月的文章), 在检索中用到以下关键词:ductal carcinoma in situ、intraductal carcinoma、 DCIS、sentinel node、sentinel lymph node biopsy、axillary lymph node、sentinel node mapping、axillary surgery 和axillary dissection。检索得到的文献用随机效应模型合并。
• 入选标准:报道乳腺导管原位癌患者前哨淋巴结阳性患者比例的文章。
• 排除标准:没有报道前哨淋巴结阳性患者比例的文章以及系统回顾。其中一个研究因为最近更新了同一组的数据也被排除。
• 评价方法:DerSimonian-Laird 随机效应模型。综合比(pooled proportion)的可信区间为95%。
• 干预措施:前哨淋巴结活检。
• 评价指标:DCIS患者前哨淋巴结转移发生率。
该项Meta分析总共包括了符合纳入标准的22篇文章。分析所得术前诊断的乳腺导管原位癌患者的前哨淋巴结转移发生率为7.4%(95%可信区间6.2%~8.9%), 而术后确诊乳腺导管原位癌患者的发生率为3.7%(95%可信区间2.8%~4.8%)。两者之间的差异有统计学意义, 危险比为2.11(95%可信区间1.15~2.93)。
根据分析结果, 术前诊断的乳腺导管原位癌患者都应该考虑行前哨淋巴结活检。
随着乳腺癌普查网络的日趋完善, 越来越多的早期乳腺癌患者被早期诊断, 研究数据显示, 2010年美国预期新发浸润性乳腺癌病例209 060例, 预期新发DCIS病例54 010例[1]。DCIS占欧美国家新发乳腺癌的比例已超过20%, 我国DCIS的比例也在不断增长, DCIS的规范诊断和治疗日益受到重视。
由于具有较高级别的循证医学证据支持, DCIS患者乳腺原发肿瘤的局部处理已达成共识, 包括乳腺切除术、肿瘤扩大切除术联合或不联合放疗。DCIS患者由于整体腋窝淋巴结转移率很低, 其临床腋窝处理也从上世纪八十年代的腋窝淋巴结清扫术(axillary lymph node dissection, ALND)过渡到九十年代的临床观察。随着乳腺癌前哨淋巴结活检术(sentinel lymph node biopsy, SLNB)这一微创分期技术的应用, DCIS患者的腋窝处理也需要达成新的个体化诊疗模式共识。由于DCIS患者腋窝处理尚缺乏前瞻性随机临床试验结果, 回顾性分析由于各个研究的样本量较小, 各研究的人群选定、SLNB技术和病理分析方法(取材量、HE染色vs. 免疫组化染色)不同, 报道的DCIS腋窝淋巴结转移比例有较大差异, 本评价文献对2007年以前发表的相关资料进行荟萃分析, 其荟萃分析结果对NCCN指南及St. Gallen会议SLNB共识的达成发挥了重要作用腋窝淋巴结状态是乳腺癌患者最重要的预后指标[2], 有助于明确分期、评估预后、确定辅助治疗方案及改善局部区域控制。SLNB已替代ALND成为临床早期浸润性乳腺癌患者腋窝淋巴结分期的金标准[3]。理论上, DCIS患者由于肿瘤中没有浸润成分, 因此不应出现腋窝淋巴结转移, 对其进行常规腋窝淋巴结分期(ALND或SLNB)属于过度治疗。但临床工作中经常遇到DCIS患者出现腋窝淋巴结阳性的情况, 原因在于肿瘤常规病理诊断的取样误差导致了肿瘤中可能存在隐匿性, 即常规病理无法发现的浸润成分, 如对所有肿瘤组织进行连续切片, DCIS患者的常规病理诊断可能升级为导管原位癌伴微浸润(ductal carcinoma in situ with micro-invasion, DCISM)或浸润性导管癌。连续取材可以减少取样误差, 但病理取材的间隔性决定了取样误差的不可避免。本文献荟萃分析显示术后明确DCIS诊断的患者其SLNB阳性率为3.7%, 随后发表的资料见表1。中国抗癌协会乳腺癌专业委员会多中心协作— — 中国乳腺癌前哨淋巴结活检替代腋窝清扫术多中心研究CBCSG-001系列研究相关结果显示术后病理诊断为DCIS的患者的SLNB阳性率为3.8%, 超声示肿瘤较大和高组织学分级的DCIS患者SLNB阳性率较高, DCISM患者SLNB阳性率为12.5%, 显著高于DCIS患者, 年轻DCISM患者SLNB的阳性率较高(内部资料)。
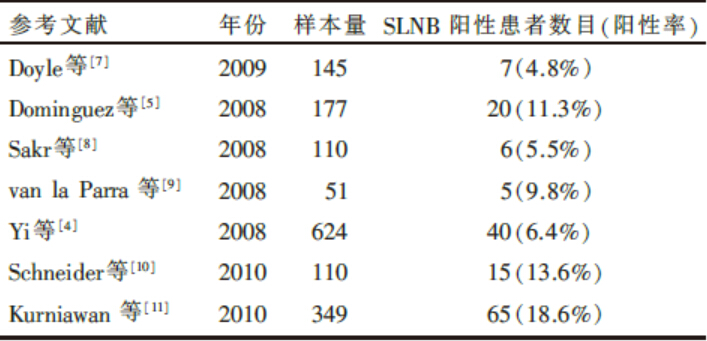
术前活检病理诊断同样存在局限性, 10%~30%术前空芯针活检病理诊断为DCIS的患者术后病理可能升级为DCISM或浸润性导管癌。本文献荟萃分析结果显示术前空芯针活检诊断为DCIS的患者SLNB阳性率为7.4%, 显著高于术后明确诊断为DCIS的患者。此后发表的资料见表2。虽然目前尚缺乏证实哪些术前诊断为DCIS患者需接受SLNB的循证医学模型, 但对于高度怀疑存在浸润成分的DCIS的患者应该建议其接受SLNB, 这些预测因素包括肿瘤较大、临床肿物可触及、钼靶可见肿物、高组织学分级、空芯针活检的病理诊断等。
| 表2 术前活检病理诊断为DCIS 患者的SLNB 阳性率 |
美国临床肿瘤学会的指南推荐对接受乳房切除手术或者乳房重建手术[12]、肿瘤较大或高组织学分级的接受保乳手术的DCIS患者需同时接受SLNB, 但该指南是2006年制定的, 至今未根据最新的循证医学证据进行更新, 其指导意义大打折扣。2011版NCCN指南指出[13], 接受保乳手术的DCIS患者不需同时接受SLNB, 而接受乳房切除手术或乳房重建手术的患者需要接受SLNB, 因为乳房切除术或乳房重建手术后原有的乳房淋巴引流途径将发生变化, DCIS患者若术后病理发现有浸润性成分时将没有机会接受SLNB, 而接受保乳手术的患者如术后病理发现浸润成分, 仍可接受二次手术完成SLNB。2011年St. Gallen专家共识认为乳腺癌患者的腋窝处理依靠SLNB状况和乳腺手术方式, 而不考虑患者乳腺原发肿瘤的类型。SLNB孤立肿瘤细胞转移患者, 无论是接受乳房切除术还是接受保乳手术, 共识专家都不同意常规施行腋窝淋巴结清扫术, 且孤立肿瘤细胞转移在SLNB内的具体部位并不改变腋窝手术方式的选择。单个SLNB微转移患者接受保乳手术时, 无论微转移灶的相对大小如何, 大多数共识专家认为可以不施行腋窝淋巴结清扫术。大多数共识专家认为ACOSOG0010、ACOSOG0011研究入组保乳手术和全乳房放疗患者(同时满足)的研究结果不适合推广应用于接受乳房切除术的患者, 乳房切除术患者SLNB微转移或宏转移时, 仍应接受腋窝淋巴结清扫术。中国抗癌协会乳腺癌专业委员会2011版乳腺癌前哨淋巴结活检指南认为DCIS患者接受乳房切除术或保乳手术范围可能影响到随后的SLNB时推荐同期进行SLNB, DCISM患者无论何种手术方式都需要接受SLNB。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|