 | 廖宁, 乳腺肿瘤学医学博士, 法国DESS学位。广东省人民医院肿瘤中心乳腺科行政主任。2010美国NCCN肿瘤临床指引(中国版)专家组成员, 中国抗癌协会乳腺癌专业委员会委员。1997-1999年赴法国国家肿瘤中心乳腺外科深造, 2003年在美国OHIO深造, 2006年在丹麦欧登塞大学医学院乳腺癌化疗内科进修学习。在导师吴一龙教授引领下一直从事乳腺肿瘤单病种临床工作多年, 致力于乳腺癌单病种规范化、个体化多学科综合治疗及相关研究, 组织和推动乳腺癌多学科协作。 |
Wapnir IL, Dignam JJ, Fisher B, et al. Long-term outcomes of invasive ipsilateral breast tumor recurrences after lumpectomy in NSABP B-17 and B-24 randomized clinical trials for DCIS[J]. J Natl Cancer Inst, 2011, 103(6):478-488.
1a。
• 同侧乳腺癌复发(ipsilateral breast tumor recurrence, IBTR)是导管原位癌(ductal carcinoma in situ, DCIS)行区段切除术后最常见的治疗失败事件。包括同侧浸润性乳腺癌复发(invasive IBTR, I-IBTR)和同侧导管原位癌复发(DCIS-IBTR)。
• 关于区段切除术后的同侧乳腺癌, 特别是浸润性同侧乳腺癌的复发风险, 目前尚未有统计数据发表。
• 所有浸润性乳腺癌都有相应的转移风险, 因此观察I-IBTR对长远预后的影响十分重要。
• 比较行区段切除术后, 不同的辅助治疗方式(放疗、放疗+他莫昔芬治疗)对同侧乳腺浸润性癌复发(I-IBTR)风险和其他事件发生率的影响。
• 评价I-IBTR和其他事件对死亡率的影响。
• 研究条件:两项前瞻性随机对照临床试验 NSABP B-17与B-24的联合分析。
• 研究起止时间:NSABP B-17:1985年10月至2007年5月; NSABP B-24:1991年5月至2007年5月。
• 研究方法:前瞻性、随机对照、双盲试验。
• 研究对象:纳入NSABP B-17中的研究对象为, 曾接受区段切除术、切缘无肿瘤的导管原位癌患者。纳入NSABP B-24中的研究对象为, 曾接受区段切除术的导管原位癌患者, 若切缘含有导管原位癌细胞或者钼靶仍显示未清除的点状钙化则需放射学表现未提示浸润癌。
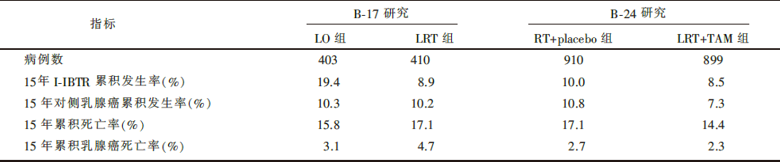
• 干预措施:NSABP B-17研究入组患者共818人, 被随机分为二组:第一组患者仅行乳腺肿瘤切除术(lumpectomy only, LO, n=403), 第二组患者在区段切除术后行放疗(lumpectomy followed by radiotherapy, LRT, n=410); NSABP B-24入组患者共1 084人, 被随机分为二组:第一组患者在区段切除术后行放疗, 同时予安慰剂治疗5年(LRT+placebo, n=900), 第二组患者在切除术后行放疗, 同时予他莫昔芬治疗5年(LRT+TAM, n=899)。之后随访期间, 每半年一次临床检查, 每年一次钼靶片检查。
B-17试验中, LRT组是在区段切除术后8周内行全乳放疗(LRT, n=410), 剂量为50 Gy, 10 Gy/W。B-24试验中, 研究可以根据患者情况加用10 Gy的剂量放疗。
• 评价指标:主要终点指标为无事件生存率, 定义为从手术结束到发生以下任何事件:同侧乳腺浸润性癌复发、同侧乳腺导管原位癌复发、其他局部复发、区域复发、远处复发、对侧乳腺浸润癌、对侧乳腺导管原位癌、第二原发肿瘤或者在这些事件之前发生的死亡。同侧乳腺浸润性癌复发(I-IBRT)是其中最受关注的事件。
• 至2007年5月, NSABP B-17研究最终入组813人, 中位随访时间为207个月; NSABP B-24研究最终入组1 809人, 中位随访时间为163个月。
| 表1 15年事件累积发生率 |
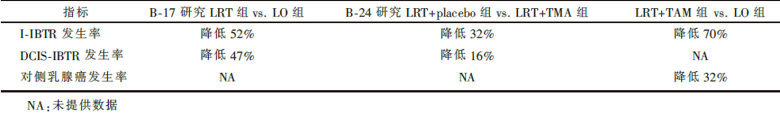
| 表2 各组间事件发生率情况比较 |
• I-IBTR为首发事件的263个女性中, 39人死亡, 其中22人死于乳腺癌。出现I-IBTR后, 各种因素导致的死亡率均较未出现复发者增加(风险比1.75, 95%可信区间1.24~2.45), 其中由乳腺癌导致的死亡率增加更明显(风险比7.06, 95%可信区间4.14~12.03)。
• DICS-IBTR出现后, 总死亡率或者因乳腺癌死亡率与未出现者相比, 差异无统计学意义。
• DCIS区段切除术治疗后最常见的事件是IBTR, 区段切除术后行放疗, 能明显降低IBTR的发生率, 区段切除术后行放疗+他莫昔芬治疗能明显降低IBTR(I-IBTR、DCIS-IBTR)、对侧乳腺癌的发生率。
• DCIS行区段切除术后长期预后很好, 但术后出现I-IBTR会使预后变差(各种因素导致的死亡率均增加), I-IBTR是DCIS主要但不是唯一的乳腺癌相关死亡原因。
• DCIS-IBTR对死亡率没有影响。
在过去的二十年里, 随着乳腺钼靶筛查的开展, 越来越多的新发导管原位癌被诊断出来。在美国, DCIS占新发乳腺癌的比例大约为25%[1, 2]。显然, 保乳术在DCIS的治疗中占据着重要的地位。早在上世纪80年代, 就有大量高级别的循证医学证据提示在DCIS患者乳腺肿瘤的局部处理上, 保乳手术与全乳切除术相比, 有相似的总生存率[3, 4, 5]。但是仍缺乏大型随机临床研究评价DCIS患者在接受保乳手术后, 后续同侧乳腺复发, 特别是同侧乳腺浸润性癌发生的风险。由于所有浸润性乳腺癌都伴随着转移风险, 因此对那些接受保乳手术的DCIS患者, 评价发生同侧浸润性乳腺癌复发风险对其长期预后的意义是非常重要的。
另一方面, 由于DCIS良好的预后, 这些患者在外科手术之后, 是否能够从辅助放疗或内分泌治疗中获益一直存在着很大的争议, 导致DCIS的治疗策略主要依靠医生的个人执业习惯来决定, 并非高级别的循证医学证据。
有鉴于此, 美国NSABP协助组在1985年展开了首个在DCIS患者中比较局部切除与局部切除加放疗两种方法对同侧复发发生风险影响的临床试验(NSABP B-17)。1991年又开展了B-24试验, 其设计是评价局部切除加放疗后再联合他莫昔芬是否能获得更好的临床获益。这两项试验在随后报道的中期随访数据时均获得了阳性结果。B-17研究在1993年报道的首次5年随访结果显示, DCIS在保乳术后追加放疗可使同侧乳腺局部复发风险降低60%[6]。而B-24研究在2001年报道的10年随访结果则证实DCIS患者在局部切除加放疗后联合他莫昔芬内分泌治疗能降低同侧局部复发风险31%, 且同时降低对侧乳腺癌发生风险53%[7]。
2011年JNCI上发表了关于联合NSABP B-17与NSABP B-24两项研究最新15年随访的结果, 更进一步加强了先前的结论。总共纳入分析的患者达到2 612例, 中位随访时间分别为207个月(B-17)和163个月(B-24)。尽管DCIS各不同治疗组的15年生存率均在85%以上, 但发生同侧浸润性乳腺癌复发患者死亡的风险比无同侧浸润性乳腺癌复发者大约高2倍。如果死因为乳腺癌, 则同侧浸润性乳腺癌复发患者的死亡风险比无同侧浸润性癌乳腺复发者大约高 7倍。同时, 发生对侧乳腺癌也是死亡风险增加的一个不良因素。
上述结果强烈提示, 降低同侧浸润性乳腺癌复发的风险及对侧乳腺癌的风险, 将可有效地改善DCIS的长期生存。而这项联合分析的结果进一步确定保乳术后的DCIS患者可从放疗及内分泌治疗中获益:追加放疗可以降低52%的同侧浸润性乳腺癌复发风险; 在放疗的基础上联合他莫昔芬内分泌治疗则可进一步降低32%的同侧浸润性乳腺癌复发风险, 同时, 对侧乳腺癌的发病率也得到了降低。相反, 单纯行乳腺区段切除的保乳术而不加放疗及内分泌治疗的DCIS患者, 其同侧浸润性乳腺癌复发的15年累积风险则高达35%, 不得不引起我们警惕。
我们也必须注意到, B-17和B-24两项研究还是存在着一些明显的不足。首先, 是这两项研究均为20年之前的设计, 当时之影像学技术与今日之影像学技术不能同日而语。很多纳入的病例以今日之影像学来衡量, 其诊断会大有不同。其次, 这两项研究均纳入了外科切缘阳性或状态未明的病例, 一定程度上增加了入组患者的异质性, 使研究结果的可靠性打了折扣。最后, 患者在入组时并未检测激素受体及HER2受体的状态, 他莫昔芬的应用并未以激素受体状态作为指引。鉴于激素受体及HER2受体状态在当今乳腺癌预后及疗效预测方面的重要作用, 这一点的确令人遗憾。
尽管如此, 这项联合分析的结果的发表, 仍然使我们获得了目前DCIS治疗领域关于保乳术、放疗及内分泌治疗最高级别的循证医学证据, 一定程度上为这些争议作出了裁决。我们有理由相信, DCIS保乳术后追加放疗、激素受体阳性者给予内分泌治疗, 将逐渐成为DCIS保乳术后的标准辅助治疗方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|