作者简介:杨衿记(1967-),男,广东阳江人,主任医师,医学博士,研究方向为肺癌的多学科综合治疗。
国际肺癌研究协会(International Association for the Study of Lung Cancer, IASLC)/美国胸科学会(American Thoracic Society, ATS)/欧洲呼吸学会(European Respiratory Society, ERS)于今年2月份颁布了肺腺癌的国际多学科分类新标准 (Travis, et al. JTO 2011)。这种腺癌新分类与既往由病理学家主导制定的肺癌分类标准显著不同, 涉及到临床肿瘤学、分子生物学、病理学及放射影像学等方方面面, 反映了近年来肺腺癌的最新研究进展。过去仅仅基于病理学的肺腺癌分类方法已经无法适应多个学科领域参与的个体化医学时代。肿瘤患者的个体化医学主要强调三个基本特征:存在控制肿瘤生长的疾病特异性基因或基因谱、利用标准的生物标志物能够确定分子靶点和针对癌基因的靶点治疗有效[1]。在个体化医学时代, 明确特异的基因型并给予靶向特异性有效治疗, 我们就能实现肿瘤患者的个体化治疗(personalized therapy)。新颁布的肺腺癌分类, 是否更有利于实施肺癌患者的个体化治疗呢?
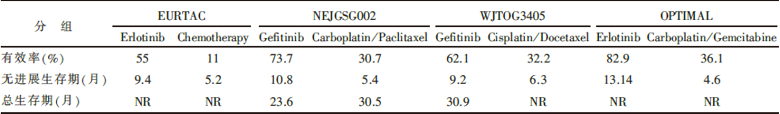
IASLC/ATS/ERS分类标准推荐晚期肺腺癌患者检测表皮生长因子受体(epidermal growth factor receptor, EGFR)突变状态。IPASS、NEJGSG002、WJTOG3405、OPTIMAL和EURTAC等临床研究结果显示, EGFR突变是EGFR酪氨酸激酶抑制剂(tyrosinase inhibitor, TKI)治疗晚期肺腺癌疗效及无进展生存的有效预测因子。EGFR突变筛选出的肺腺癌患者一线接受EGFR-TKI治疗的无进展生存期和客观有效率都显著优于含铂双药化疗者, 见表1。因此, 在临床实践中, 对于EGFR基因敏感突变的晚期肺腺癌患者, 推荐一线EGFR-TKI治疗; 对于没有EGFR基因敏感突变或EGFR基因突变状态不明的晚期肺腺癌患者, 强烈推荐一线含铂双药化疗。或者说, 携带EGFR敏感突变的病人接受EGFR-TKI治疗是“ Rational” , 对没有敏感突变的病人进行EGFR-TKI治疗是“ Harmful” 。 在临床试验中, 也应该慎重对待晚期肺腺癌患者中EGFR突变型和野生型两大类人群, 保证高质量临床试验的实施, 更有利于肺癌患者的个体化治疗。
| 表1 有关EGFR突变型晚期NSCLC化疗与EGFR TKI的随机对照研究 |
在非小细胞肺癌(non-small cell lung cancer, NSCLC)患者中最近发现了一种新的预测标志物— EML4/ALK融合基因突变。这一改变可导致肿瘤基因ALK结构激活。一项纳入82例确诊存在ALK融合基因(FISH法)NSCLC患者的Ⅰ 期扩大队列研究(Kwak, et al. NEJM 2010)显示, Crizotinib(PF02341066, 一种ALK和MET的抑制剂)的总体有效率达到57%, 估计的6个月无进展生存率为72%。在接受ALK抑制剂治疗的过程中, 有报道EML4-ALK激酶域可出现再次耐药性突变。Crizotinib治疗复治晚期ALK融合基因阳性NSCLC的Ⅱ 、Ⅲ 期临床试验也正在紧锣密鼓地入组受试者。可以预见Crizotinib很快会被美国FDA批准上市。尽管ALK融合基因在总体NSCLC患者中的阳性率只有4%左右, 但对于3亿多人口的美国和13亿多的人口大国中国来说, ALK融合基因阳性肺癌患者人数可不是一个小数目。所以有评论说, Crizotinib治疗仅有4%左右的ALK融合基因阳性NSCLC患者是一个经典的肺癌个体化治疗案例。有趣的是, EGFR和 KRAS基因均为野生型的高加索肺腺癌患者中ALK融合基因阳性率(FISH法)高达30%多, 而EGFR和 KRAS基因均为野生型的中国肺腺癌患者中ALK融合基因阳性率(RACE-coupled PCR法)却达到了40%之多[2], 所以, 无论在Crizotinib的临床试验中还是今后临床实践的个体化治疗中, 采取“ 肺腺癌+EGFR和 KRAS分子分型” 的筛查方法是一种非常实用的策略。
在乳头状肺腺癌和微小乳头状肺腺癌中突变率分别占5%和20%的BRAF基因, 却首先在黑色素瘤中成为Vemurafenib个体化治疗的靶点, 真是意想不到的“ 墙外开花” 。Sloan-Kettering纪念癌症中心报告了一项比较BRAF抑制剂Vemurafenib与达卡巴嗪(Dacarbazine)初始治疗BRAF V600E突变型黑色素瘤患者的开放性多中心随机Ⅲ 期临床试验(BRIM3)[3]。结果显示Vemurafenib组的总生存期、无进展生存期和有效率显著胜出(总生存期的风险比为0.37, 95%可信区间 0.26~0.55, P< 0.000 1; 无进展生存期的风险比为0.26, 95%可信区间0.20~0.33, P< 0.000 1; 有效率为48% vs. 5%)。
虽然我们目前还不敢肯定BRAF基因突变型的肺腺癌接受Vemurafenib能够取得成功的个体化治疗, 但上面几个例子说明了只要符合肿瘤患者个体化医学的三个基本特征, 则可顺利地实施肿瘤患者的个体化治疗。结合分子或基因分型的肺腺癌新分类标准, 更有利于晚期肺癌的个体化治疗。
新分类认为肺癌不能仅通过光学显微镜分类, 特定的检查如免疫组化和/或黏蛋白染色应被应用于进一步的肿瘤分类, 要尽量减少使用NSCLC-NOS(not otherwise specified)术语的机会。这种临床思维的转变对于晚期肺癌的药物选择至关重要。有研究提示:对比鳞状上皮癌, 腺癌是培美曲塞治疗有效的强有力预测因子。Scagliotti等对比了培美曲塞/顺铂与吉西他滨/顺铂, 亚组分析显示腺癌患者的中位生存期明显延长(12.6个月 vs. 10.9个月), 大细胞癌(目前可被称为NSCLC-NOS)的总体生存期为10.4个月 vs 6.7个月, 同时在鳞癌患者中培美曲塞组并未显示生存获益。Ciuleanu等进行的培美曲塞对比安慰剂的Ⅲ 期临床试验中预设的组织学类型亚组分析显示, 腺癌患者的无进展生存期 (4.5个月 vs. 1.5 个月, P< 0.000 1)和中位生存期(16.8个月 vs. 11.5 个月, P< 0.000 1)均明显延长。ECOG 4599研究(Sandler, et al. NEJM 2006)结果证实, 贝伐单抗联合紫杉醇/卡铂一线治疗非鳞型NSCLC较单纯紫杉醇/卡铂化疗能显著提高客观缓解率(27% vs. 10%)及无进展生存期(6.4个月vs. 4.5个月), 同时也显著延长患者的生存时间:中位生存期分别为12.5个月和10.2个月。潜在的致命性大出血可发生在接受贝伐单抗治疗的鳞状上皮癌患者中。
上述证据表明, 从肺癌临床实践的宏观角度看, 腺癌可作为培美曲塞或含铂双药+抗血管生成治疗有效的预测因子, 而鳞状上皮癌很可能是肺癌患者接受贝伐单抗治疗致命毒性的预测因子, 因此优化了晚期肺癌的治疗策略, 在现阶段我们权且当组织类型是宏观个体化治疗的靶点。但是, 上述治疗不完全符合肿瘤患者个体化医学的三个基本特征, 还不是真正意义的分子水平的个体化治疗。比如说腺癌可作为培美曲塞治疗有效的预测因子, 它的分子机制是什么呢?是腺癌的胸苷酸合成酶(TS)mRNA表达水平比肺鳞癌和小细胞肺癌显著降低吗?我们目前还没有确凿的证据, 需要深入的基础研究和转化性研究。
毋容置疑, 结合分子或基因分型的肺腺癌新分类标准, 更有利于实施晚期肺癌分子水平的个体化治疗。肺腺癌新分类仅靠组织类型只能在宏观上有助于晚期肺癌的个体化治疗, 但肺腺癌这个组织学诊断只是基因型或分子分型的表面现象, 我们只有进行深入的探索性研究以确定肺腺癌里面更多的基因型或分子分型, 并且研发出针对这些基因型或分子分型的有效药物, 特别是分子靶向药物, 才能实现真正意义上的肺癌个体化治疗。借助于肺腺癌新分类这座桥梁, 今天, 我们拥有了EGFR基因突变型肺癌和EML4/ALK基因融合型肺癌; 明天, BRAF基因突变型肺癌很可能就向我们招手了。
尽管肺鳞癌目前还没有赶上肺腺癌的研究进展, 但肺腺癌新分类和分子分型的成功经验, 毫无疑问地为肺鳞癌的个体化治疗提供了指路明灯。 肺癌个体化治疗的春天就要来临。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|