正当我们仍在对2004年WHO肺癌病理分类津津乐道的时候, 今年年初国际肺癌研究协会(International Association for the Study of Lung Cancer, IASLC)、美国胸科学会(American Thoracic Society, ATS)及欧洲呼吸学会(European Respiratory Society, ERS)又联手推出了新版的肺腺癌分类。停下匆匆步履, 惊觉网络时代的紧迫和无情更替:1967年人们把肺腺癌分为支气管源性和肺泡源性; 1981年提出了腺泡状腺癌、乳头状腺癌, 细支气管肺泡癌(bronchioloalveolar carcinoma, BAC)、实性腺癌四种基本分类; 1995年Noguchi发现肺腺癌六种预后不同的分型后, 近十数年, BAC成为了肺癌研究领域的主角之一; 2004年肺腺癌表皮生长因子受体(epidermal growth factor receptor, EGFR)活化突变的发现, 更使高突变率的BAC腺癌混合亚型成为热词。按照2011年版的新分类标准, 引入原位腺癌(adenocarcinoma in situ, AIS)的新概念取代原来的单纯型BAC; 以鳞屑状生长为主、浸润成分小于5 mm的微侵袭腺癌(minimally invasive adenocarcinoma, MIA)取代原来BAC伴局灶浸润。这两类患者淋巴结转移发生率极低, 如接受手术切除, 可获得接近100%的疾病特异性存活(disease-specific survival), 其中BAC-AIS被摘掉了恶性肿瘤这顶帽子, 和非典型腺瘤样增生(atypical adenomatous hyperplasia, AAH)同被列入癌前病变。
肺腺癌新分类让肿瘤胸外科医师有似曾相识感, AIS和MIA的概念可能移植于乳腺癌病理分类。同样, 回顾乳腺癌手术和肺癌外科发展史, 也发现两者有不少的相似之处:乳腺癌的外科手术治疗历史悠久, 至今已有2 000多年, 经历了局部切除、乳腺癌根治术、扩大根治术、改良根治术和保乳手术“ 由小到大, 再由大变小” 的5个阶段。肺癌外科步乳腺外科之后尘, 在诞生的短短120年间, 已经经历了肺门结构整块结扎的全肺切除、徘徊于亚肺叶切除和肺叶切除、到如今的标准解剖性肺叶切除加系统性胸内淋巴结清扫, 再到选择性亚肺叶切除和淋巴结清扫的倾向“ 由大变小, 由小变大, 再由大变小” 的4个阶段。
现今肺癌标准术式的确立是基于临床分期Ⅰ ~Ⅲ A期患者中, 肺叶切除和楔形或肺段切除对比, 可减少局部复发率; 系统性淋巴结清扫和采样术对比, 可提高术后病理分期的准确性、延长生存期两大循证医学证据。虽然“ BAC” 这一词汇将逐步淡出我们的视野, 但不管是BAC还是AIS, 这类病变生长缓慢、分化良好但善变的特性不会因而改变。而近期肺癌选择性切除的个体化外科治疗策略, 却是伴随影像学技术的进步, 对诊断毛玻璃样改变(ground-glass opacity, GGO)的敏锐度增高, 使周围型直径小于2 cm的小肺癌接受微创手术日益增多; 建立在对AAH-AIS-MIA等一系列特殊类型肺癌分子生物学特性深刻认识的基础上。
在2011年这一时点, 新分类的外科治疗策略推荐中, 选择性限制切除的地位仍未完全确立, 只是让我们看到了一种趋势。和网络时代的快相对应, 任何一种治疗理念的更新都要经历一个相对漫长的过程。这需要正电子成像术(positron emission tomography, PET)/纵隔镜/支气管内超声检查(endobronchial ultrasonography, EBUS)等术前精确分期手段的普及、术中冰冻评估肺癌原发灶、区域淋巴结和切缘水平的进一步提高, 以及更多的前瞻性随机对照研究证据, 从而更好地指导术中个体化决策。肺腺癌新分类见证了肺癌外科切除范围观念从经验到循证再到个体化这一否定之否定的螺旋式上升过程。
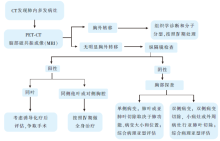
由于影像学技术的日益提高、对吸烟患者的早期筛查以及对早期肺癌患者术后的密切随访, 肺内多发病灶的检出率越来越高。鉴别多原发肺癌和肺内转移对于决定采取全身治疗还是局部治疗策略, 判断预后和探索肺癌发生发展的生物学规律都有重要意义。参考原有的Martini-Melamed标准和2007年美国胸内科医生学会(American College of Chest Physicians, ACCP)指引, 主要依据病理亚型来划分, 对于病理亚型相同的患者, 可参考多发肺内病灶是否位于同叶或同侧胸腔、淋巴结状态和胸外器官转移的情况, 结合结节大小、数目、边界和位置等影像学特征综合判断。此外, 近年多项研究通过DNA微卫星分析, LOH, X染色体失活, p53突变和综合aCGH、SNPs和基因表达谱等手段探索肺内多发病灶的克隆起源。但存在样本量小, 所分析的基因数目有限, 价格昂贵, 需要生物统计学支持、不同实验室检测平台差异以及难以向临床推广等缺陷。在肺腺癌新分类中, 推荐病理科医生使用全面组织学分型(comprehensive histologic subtyping, CHS), 核医学科医生通过PET代谢值的分布, 放射科医生根据CT值信号衰减的相似程度判断伏壁样或实体性成分的相对百分比, 从而鉴别肺内多发病灶的起源。目前, EGFR、KRAS、BRAF和EML4-ALK等主要驱动基因的状态用于鉴别多原发肺癌和肺内转移也是令人期待的研究方向。对于肺内多发病灶不伴有淋巴结转移和胸外转移的患者, 如肺功能可耐受, 选择性二次手术切除是合理的策略(图1)。
The authors have declared that no competing interests exist.