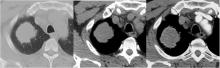
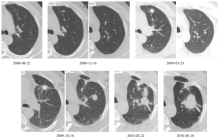
患者男性, 47岁, 因“ 肺癌综合治疗后2年余, 再次术后1个月余” 就诊。患者于2年余前CT定位下经皮肺穿刺活检(2007年12月18日)诊断:右上肺腺癌, 伴有神经内分泌分化。免疫组化:CK7(+++), CK5/6(-), CK10/13(-), TTF-1(+++), Syn(++), CgA(++)。2007年12月18日经颈纵隔镜检查术, 最后诊断为:右上肺腺癌cT2aN2M0Ⅲ A期, EGFR、KRAS野生型, 见图1。2008年1月12日至2月23日行吉西他滨1 250 mg/m2 d1、d8 + 卡铂SUC=5 d1新辅助化疗3周期, 疗效评价部分缓解, 毒副反应:粒细胞减少Ⅱ 度, 谷丙转氨酶减少Ⅱ 度。2008年3月20日行右上肺叶切除+系统性纵隔淋巴结清扫术。术后病理示:右上肺腺癌, 淋巴结0/27。术后分期下降为右上肺腺癌pT1aN0M0Ⅰ A期。2008年8月22日CT发现左上肺前段小结节, 予观察。2009年4月20日因检查发现结节增大而且左上肺新出现小结节, 予左上肺前段楔形切除术, 术中未能触及新出现的小结节。术后病理示:左上肺腺癌, 考虑为转移。患者无病生存期5个月。2009年10月23日因左上肺新出现结节继续增大, 予射频消融术, 术前先行经皮肺穿刺活检, 病理报告为腺癌(无进展生存期6个月)。2010年3月22日CT检查示左上肺结节较前有所增大(1.9 cm)。2010年8月PET-CT示左上肺结节3.9 cm, SUVmax 10.0, 其它部位未见复发转移。2010年8月19日行左上肺叶切除+肺门纵隔淋巴结采样术。术后病理示左上肺腺癌伴神经内分泌分化, 淋巴结0/8, (左上肺及肿物)肺腺癌, Ⅲ 级, 伴有神经内分泌分化。免疫组化:Syn(+++), CgA(-), CD56(-), CK5/6(-), CK7(+++), CK10/13(-), TTF-1(+++), CAM5.2(++)。EGFR野生型, KRAS突变。术后恢复好。
既往有高血压病, 脂肪肝史5年; 吸烟指数18包年, 戒烟6年; 已婚已育; 无肿瘤家族史。
体格检查:T 36.5℃, P 90次/分, R 20次/分, BP 140/85 mmHg; 神志清晰, 发育正常, 营养良好, 正常体型, 无特殊面容; 自主体位, 检查合作; 皮肤黏膜无黄染, 无皮下出血, 皮温正常。浅表淋巴结未触及; 头面部无水肿, Horner’ s Sign(-), 上腔静脉综合征(-), 胸廓无畸形, 胸部切口愈合好, 呼吸运动正常, 三凹征阴性。胸壁静脉无怒张; 胸骨无压痛, 无皮下捻发感; 双肺呼吸音清, 未闻及干湿啰音, 无胸膜摩擦音。心、腹、神经系统无异常。
廖日强(肿瘤外科主治医师):汇报病史(略)。提出讨论要点:(1)如何从影像学、病理学、分子生物学鉴别左上肺病灶为转移瘤或第二原发癌?(2)下一步的治疗方案?
杨学宁(肿瘤外科副教授):肺癌完全切除术后出现肺部新发病灶, 首先鉴别良恶性, 如果诊断为恶性还需要鉴别转移瘤和第二原发肺癌[1]。随着患者生存期的延长和随访的规范化, 临床上将遇到更多此类患者。分子生物学的进步使大家对肿瘤的异质性认识逐步提高, 并为鉴别转移病灶和第二原发癌提供新的方法。我们先从最传统的影像学来鉴别转移瘤和第二原发肺癌。
余新元(放射科副主任医师):患者2007年12月18日第1次CT检查, 右上肺病灶具有比较典型的原发性肺癌影像学特点, 肿瘤呈分叶状, 有毛刺, 增强后均匀强化。原发肺癌呈毛玻璃样改变、空泡征、胸膜凹陷征等。而左上肺病灶为转移瘤, 病灶多发, 呈圆形, 边界清楚, 密度均匀, 没有毛刺, 根据对病灶的跟踪, 认为其生长速度比较快, 见图2。当然如果转移病灶继续长大, 到一定程度时也会出现分叶、毛刺等特征。因此影像学判断认为左上肺新发病灶为右上肺癌术后转移, 而非第二原发癌。
邵丹(核医学硕士):PET-CT对鉴别良恶性肿瘤有非常重要的意义, 此患者只在第4次手术(左上肺叶切除术)前行PET-CT检查, 图像显示左上肺两个病灶, 其中一个病灶为肺楔形切除术后的纤维化改变, SUVmax无升高, 而另一个病灶代谢值升高, 考虑为恶性, 见图3。但代谢值难以鉴别转移瘤和第二原发癌, 因此PET-CT鉴别转移瘤和第二原发癌主要是根据CT的形态学特性, 而功能影像学主要用于鉴别良恶性。
罗东兰(病理科副主任医师):病理主要从病理类型和形态学鉴别第二原发癌和转移瘤。肺腺癌非常复杂, 异质性大, 虽然左上肺的病理分化程度较前差, 但形态学还是相似的, 肿瘤细胞分化差, 腺泡样, 部分腺管样改变, 可见菊形团样改变, 免疫组化支持腺癌伴神经内分泌分化。因此考虑左上肺腺癌为转移性并伴神经内分泌分化。值得注意的是在肿瘤治疗和随访过程中新出现的病灶, 不能简单认为是转移或局部复发。例如淋巴瘤的患者数年后原区域新出现的病灶甚至可能是不同类型的淋巴瘤; 再如乳腺癌经过治疗后的雌激素受体、孕激素受体等有可能发生改变。因此对新出现的病灶往往需要再次活检确认性质并进行相应的免疫组化检测。
张绪超(肺癌研究所副研究员):KRAS是肺癌中非常重要的原癌基因, 1984年首次在肺癌中发现KRAS突变, 其发生率与人种和吸烟有关, 随后的研究发现与吸烟的关系不大, 但不同的突变类型与吸烟有关。KRAS突变是化疗疗效不良的预测因子[2], 2004-2005年发现其与EGFR突变和 TKI药物的疗效密切相关, KRAS突变也是肺癌对EGFR TKI原发耐药的机制之一[3], 目前的Ⅱ 期试验提示 KRAS突变肺癌患者可能从Sorafenib获益。KRAS突变一般为癌变早期事件, 在结直肠癌中, 原发灶与转移灶KRAS的突变率高度一致。一篇Meta分析提示原发灶的检出率高于转移灶, 但此文章问题很多, 例如, 样本量不到200例, 存在肿瘤异质性和检测技术的不同[4]。本例患者右上肺野生、左上肺突变, 时间间隔5个月, 转移或第二原发皆有可能。由于组织细胞异质性和分子突变异质性以及检测方法的敏感度问题, 都有可能影响检测的结果。因此建议采用敏感性更高的方法进行检测, 鉴别转移或第二原发, 单纯KRAS指标还非常困难, 还需结合病理学及其它分子生物学指标如EGFR等来鉴别。
钟文昭(肿瘤外科副主任医师):此患者前3次的肿瘤大体标本KRAS和EGFR均为野生型, 而最后一次标本发现KRAS突变, 似乎出现了新的分子生物学病变。我们知道KRAS与EGFR突变是肺癌的早期事件, 不典型腺瘤样增生到细支气管肺泡癌到腺癌演变过程中, 不典型腺瘤样增生中KRAS突变率更高。临床上经常遇到不同部位对化疗或TKI的疗效不一样, 肿瘤的异质性是其中的重要原因, 也是近几年研究的一个热点, 国内外有多篇有关肺癌原发灶与转移淋巴结、肺内病灶、肺外转移病灶的KRAS与EGFR突变的异质性研究, 研究发现存在10%~20%的异质性, 但如果采用更敏感的突变富集的方法, 异质性减少。因为我们的实验室常规采用测序的方法检测KRAS突变, 针对本例特殊病例再次采用更敏感的突变富集法检测前3次标本均发现有KRAS突变。结果说明KRAS突变不一致是由于检测方法不一致导致的。肺内多发病灶是关注的热点, 多原发以局部治疗为主, 而转移以全身治疗为主。但有专家认为如果没有淋巴结转移, 能完全切除者, 即使是转移也建议手术。
旁述:多原发癌的诊断标准(胸部肿瘤分期手册7th):(1)组织学类型不同; (2)组织学相同, 形态学、免疫组化和/或分子生物学研究认为确实存在差异; (3)鳞癌中, 伴有原位癌, 不同亚型。符合其中一项并满足以下条件:无淋巴结转移证据, 无常见淋巴引流区淋巴结转移证据。
杨学宁:结合患者病理类型, KRAS、EGFR分子生物学指标相同, 考虑左肺病灶为转移瘤。如何鉴别肺部多发肿瘤是双原发(多原发)或转移瘤, 早在70年代Martini等就提出几个鉴别的要点, 随着影像学进步和研究的深入, ACCP 2007年指引增加了细节, 如将其定义为三类, 卫星结节、多原发和血运转移, 但实际上与以前的定义区别并不大。虽然肺癌术后新出现的病灶是否必须获得病理诊断没有列入指南, 但许多情况下, 我们需认真考虑。虽然患者开始诊断Ⅲ A期, 但从病程来看, 可能第1次手术前对侧已经有病灶, 但影像学未发现, 随访过程中, 肿瘤倍增快, 逐渐增大。传统上, 如果出现对侧转移为Ⅳ 期, 建议全身化疗, 但本例患者新辅助化疗后很快出现转移, 说明虽然左上肺病灶开始时非常小, 但仍然是耐药的, 而且患者一直是单叶转移, 局部治疗的疗效可能更好。因此一直采用局部治疗, 包括手术、射频消融等。而下一步可以继续观察、随访, 暂不考虑化疗。
鉴别肺癌术后新出现的肺部结节, 需要从间隔时间、影像学特征进行初步判断, 并且往往需要通过病理诊断, 分子生物学能提供重要的价值, 由于分子生物学检测技术的敏感性问题, 当结果不一致时需要采用更敏感的方法进行验证。对特殊转移情况, 局部治疗具有重要的作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|