| 杜欣, 女, 主任医师, 中山医科大学病理生理学博士, 中山大学医学院和南方医科大学临床医学兼职教授, 血液学博士研究生导师, 广东省人民医院肿瘤中心副主任兼血液科主任。1986年本科毕业于兰州大学医学院获学士学位; 1989年获血液学硕士学位, 任广东省人民医院内科住院医师。1997年任广东省人民医院血液科主任。2005-2007年, 多次在美国MD Anderson Cancer Center淋巴瘤和骨髓瘤科以及白血病科进修学习。现任广东省中西医结合学会血液病专业第二届委员会主任委员; 广东省医学会血液学会第六届委员会副主任委员; 广东省器官移植学会第一届委员会常委; 广东省抗癌协会血液肿瘤专业委员会第一届委员会常委; 广州市抗癌协会第三届血液肿瘤专业委员会副主任委员。《国际输血及血液学杂志》、《循证医学》和《实用医学杂志》编委。 杜欣主任长期工作在血液病临床第一线, 在各类血液肿瘤的诊治方面积累了较丰富的经验, 专治各类白血病、骨髓增生异常综合症、淋巴瘤和骨髓瘤等疾病, 并为患者制定个体化治疗方案。 |
Renato B, Giuseppe R, Enrico MP, et al. Chemotherapy-phased Imatinib pulses improve long-term outcome of adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia: Northern Italy leukemia group protocol 09/00[J]. J Clin Oncol, 2010, 28(22):3644-3652.
3a。
• 作为一种ABL1酪氨酸激酶抑制剂, 伊马替尼在费城染色体(Philadelphia chromosome, Ph)阳性急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)患者的治疗中担当重要角色。Ph+ALL患者预后差, 伊马替尼最初用于复发难治的Ph+ALL, 并显示具有相当的活性。应用伊马替尼每日剂量300~1 000 mg(中位600 mg)可以迅速起效, 清除外周循环原始细胞的中位时间仅6天。
• 体外研究证实了伊马替尼与化疗药物在药理学上的协同作用, 并且伊马替尼可维持化疗药物诱导肿瘤细胞凋亡的活性, 从理论上可以帮助克服Ph+原始淋巴细胞对化疗药所产生的耐药。
• 在临床试验中, 最初采取14天伊马替尼疗程联合Hyper-CVAD方案, 与历史对照相比, 改善了早期生存。以后进行的不同的伊马替尼和化疗方案组合均不同程度上改善了预后, 使得1~2年、3年、4年总生存率分别提高至36%~76%、23%~78%、30%~52%, 并且增加了患者接受异基因造血干细胞移植的机会。
• 既往的临床研究中, 伊马替尼一般至少用14天, 甚至连续用8周直至进行造血干细胞移植, 且伊马替尼与化疗同时进行或序贯进行。
探索伊马替尼短期脉冲治疗联合化疗对提高Ph+ ALL患者的总生存率(overall survival, OS)、长期无病生存率(disease-free survival, DFS)、优化完全缓解率(complete remission, CR)和干细胞移植(stem-cell transplantation, SCT)率的作用。
• 研究条件:意大利北部白血病协作组多家医疗中心接受NILG09/00方案的患者。
• 研究方法:历史对照研究。
• 入组时间:历史对照组(仅化疗组, IM-组)开始于2000年4月, 研究组(短程伊马替尼加化疗组, IM+组)开始于2003年2月, 数据分析结束于2009年7月。
• 研究对象和措施:纳入94名患者(年龄19~66岁), 35名患者为不加用伊马替尼组(IM-组); 59名接受伊马替尼治疗(IM+组), 用法为600 mg/d, 连续口服7天, 在第1化疗疗程的第15天开始服用, 第2~8疗程化疗前3天开始服用。缓解后的病人可以选择异基因SCT, 或者大剂量化疗后自体SCT并后续维持化疗间断服用IM。
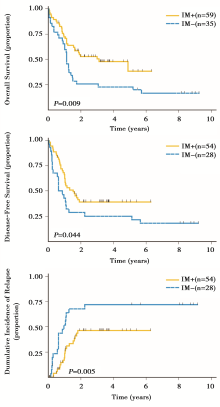
IM+组的CR高于IM-组( 92% vs. 80.5%, P=0.08)。中位随访期5年(0.6~9.2年), 在CR1期间, IM+组22例存活, 而IM-组仅5例存活(P= 0.037)。早期治疗失败率IM-组31.5%(11/35, 5例难治, 6例早期复发), IM+组8.5%(5/59, 2例难治, 3例早期复发)(P=0.004)。IM-组SCT率为54%(其中11例异基因SCT, 4例自体SCT); IM+组的SCT率为72%(其中34例异基因SCT, 5例自体SCT)。IM+组接受异基因SCT的患者比例明显高于IM-组(63% vs. 39%; P=0.041), 尤其是非血缘移植(P=0.004)。IM+组5年OS和DFS均高于IM-组(OS:0.38 vs. 0.23, P=0.009; DFS:0.39 vs. 0.25, P=0.044 ), 复发率低于后者(P =0.005 )。IM+组SCT相关死亡率为28% (15/54), 移植后总体生存率达46%。见图1。
化疗联合IM 600 mg持续7天的短程脉冲方案改善了Ph+成年ALL患者的预后。对于移植患者, 移植相关死亡和复发仍是阻碍疗效提高的主要障碍。
随着首个酪氨酸激酶抑制剂— — IM被应用于Ph+ ALL患者以来, 大量临床研究证明, 化疗联合IM, 可显著改善患者的长期生存。无论是接受单纯化疗(10% vs. 30%)或造血干细胞移植(35% vs. 73%)的Ph+ ALL患者, 均可从中获益[1, 2]。IM联合化疗已成Ph+ ALL的标准治疗方案, 但关于IM使用的时机存在两派意见[3, 4, 5]: ①以MD Anderson 癌症中心的 Thomas 为代表的学者, 主张从诱导治疗开始, 同时给予IM 600 mg/d, 持续至2年。CR可达90%~96%, 分子生物学缓解率从< 5%提高至 > 50%, 长期OS提升至> 50%。②德国GMALL组提出化疗间歇期给药, 该研究组对同时或序贯给药进行了研究, 发现同时给药虽增加了BCR-ABL转录本的下降(52% vs. 19%, P=0.01), 但不影响CR与OS; 且发现IM联合左旋门冬酰胺酶或6-MP可增加肝毒性作用。总之, 尽管IM联合化疗方案改变了Ph+ ALL的预后, 但如何合理应用IM, 克服耐药突变、降低治疗费用和不良反应, 进一步提高疗效等问题, 仍需进行深入的研究。
意大利北部白血病组基于以下几个因素, 首次提出短程、间歇IM联合传统化疗的治疗模式(NILG 09/00方案):①IM长期暴露增加耐药突变的发生, ②IM快速(6天)清除外周血中白血病细胞的作用, ③IM与化疗药物具协同作用等。NILG 09/00方案为在诱导治疗开始后第15天、每次强化巩固化疗前3天, 连续给予7天IM 600 mg/d, 至异基因造血干细胞移植或连续8个疗程后进入强化自体移植或维持治疗。并通过与历史病例对照的方法得出了以下结果:①NILG 09/00方案诱导初治Ph+ ALL的CR高于非IM组(92% vs. 80.5%, P=0.08), 而且不增加不含左旋门冬酰胺酶诱导方案的治疗毒性作用。与文献报道一致, NILG 09/00方案与其他长疗程的IM单药/联合激素或IM联合化疗的其他诱导方案的CR率接近(90%~100%), 故认为短程、间歇IM联合化疗可获得较好的CR, 避免了长疗程的副作用并降低治疗费用。②改善Ph+ ALL的长期生存, NILG 09/00方案组5年OS和DFS明显高于非IM的对照组(OS:0.38 vs. 0.23, P=0.009; DFS:0.39 vs. 0.25, P=0.044)。从该文提供的数据来看, NILG 09/00方案的疗效似乎不如其他IM联合化疗的临床报告(1~4年DFS 43%~73%), 原因在于本研究的IM组59例患者中, 6例在诱导期没有使用IM, 仅在后来的巩固强化中应用。当把这6例患者剔除重新统计分析时, 该IM组5年OS可达48%, 疗效与文献报道是一致的[1, 2, 3, 4, 5], 故短程、间歇性IM联合化疗的长期生存并不亚于长期、序贯的治疗模式; 同时, 该结果更加突出了IM在诱导治疗中的重要性。③该研究显示IM提高单纯化疗组的3年DFS(8% vs. 0%, P=0.01), 而不影响异基因或自体移植患者的OS与DFS(P> 0.28), 与文献报道不一致[1, 2, 6], 可能与进入移植组均为获得CR的患者且对照组样本量小(n=15 vs. 39)的选择性偏差有关。
该研究对传统长疗程、序贯或持续应用IM的治疗模式提出了挑战。短程、间歇IM联合化疗的治疗模式可能取代传统的治疗模式。但因本研究为非前瞻性、非同期随机对照临床研究, 病例数偏少, 存在偏差; 需进一步的前瞻性随机对照研究进一步证实短程、间歇等同或优于长期持续治疗。另外, 短程、间歇治疗是否能减少ABL激酶区突变率?巩固强化后TKI该如何应用?600 mg/d的剂量是否最佳?TKI时代, Ph+ ALL是否还必须行异基因造血干细胞移植?中枢神经系统白血病的防治策略等仍是作者留给读者思考的问题。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|