| 李建勇, 主任医师、教授、博士研究生导师、博士后合作导师。1988年北京医科大学临床医学专业毕业, 1988年和1997年分别在苏州医学院获内科血液学硕士和博士学位。曾在法国、英国、德国做博士后研究及短期访问学者。现为国家临床重点专科— 南京医科大学第一附属医院(江苏省人民医院)血液科主任、江苏省高校优秀科技创新团队首席专家。中华医学会血液学分会委员、实验诊断学学组副组长、遗传学诊断工作组组长、淋巴瘤工作组副组长; 中国抗癌协会血液肿瘤专业委员会副主任委员; 国际骨髓瘤基金会中国多发性骨髓瘤工作组成员; 中国病理生理学会实验血液学会委员, 中国免疫学会血液免疫分会常委(流式学组常委), 中华血液学杂志等7种杂志编委。江苏省医学领军人才、江苏省优秀医学重点人才、江苏省“ 333高层次人才” 及“ 六大高峰人才” 。江苏省青年科技奖获得者、江苏省优秀回国人员, 全国医药卫生系统先进个人, 享受国务院政府特殊津贴。主持国家自然科学基金(3项)、江苏省重大项目等课题20余项。第一/通讯作者发表SCI论文50余篇。主编或参编专著10部。获省部级科技进步二、三等奖8项。主要研究方向:淋巴肿瘤和血液病的诊治。 |
Nachman JB, La MK, Hunger SP, et al. Young adults with acute lymphoblastic leukemia have an excellent outcome with chemotherapy alone and benefit from intensive postinduction treatment: A report from the children’ s oncology group[J]. J Clin Oncol, 2009, 27(31):5189-5194.
1b。
• 年轻成人(16~21岁)的急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)与儿童ALL相比, 无病生存率((disease-free survival, DFS)和总生存率(overall survival, OS)均显著低下, 其主要原因在于前者的T细胞及费城染色体(Philadelphia chromosome, Ph)阳性率较高, 而t(12; 21)及超二倍体这些具有良好预后的ALL比例较低[1, 2, 3, 4]。
• 在美国的儿童肿瘤研究协作组(Children’ s Cancer Group, CCG)的CCG1882研究已经显示对于儿童ALL早期骨髓缓解延迟(第7天骨髓原始细胞大于25%)的患者, 缓解后的强化治疗显著提高了其DFS和OS[5]。
• CCG1961研究结果提示, 缓解后的强化治疗显著提高了快速早期缓解患者(rapid early responder, RER)的DFS, 但对于OS无明显影响[6]。CCG1961并没有对16~21岁年龄组进行独立分析。
分析儿童肿瘤研究组CCG1961研究中16~21岁年轻成人ALL的治疗结果, 探讨缓解后强化治疗在该年龄组中的作用。
• 研究条件:美国儿童肿瘤研究协作组临床研究项目CCG1961。
• 研究起止时间:1996年11月至2002年5月。
• 研究方法:多中心、前瞻性、随机对照临床研究。
• 研究对象:CCG1961研究入组的ALL患者年龄1~21岁, 初诊白细胞数量在50× 109/L或年龄大于10岁; 所有患者均签署知情同意书, 试验已通过伦理委员会批准。
• 干预措施:所有患者的诱导化疗均采用常规的VDLP方案, 以甲氨蝶呤和阿糖胞苷鞘内注射预防中枢神经系统白血病。对于RER患者随机将其分为标准BFM方案治疗组和强化BFM治疗组; 对于慢速早期缓解患者(slow early responder, SER)采用强化治疗方案处理。共有262例患者进入统计分析, 其基线资料见表1。
• 评价指标:不良事件、无事件生存率(event-free survival, EFS)、OS和预后。
| 表1 患者的基线情况 |
在该年轻成人ALL亚组中, 有71例患者出现了不良事件, 见表2。
| 表2 两组的不良事件情况(例) |
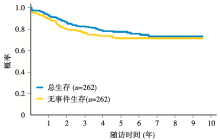
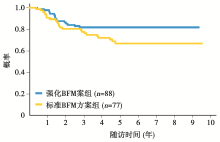
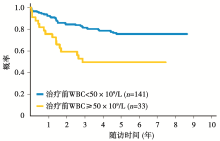
262例ALL患者中, 5年EFS为 71.5% (标准误3.6%); 5年OS为 77.5% (标准误3.3%), 见图1。在所有的RER患者中, 应用强化BFM方案患者的5年EFS率(81.8%± 5.4%)显著高于标准BFM方案组(66.9%± 6.7%), P=0.07, 见图2; 而5年OS两者差异无统计学意义, 强化组83.2%± 6.8%, 标准治疗组75.6%± 7.7%, P=0.14。对于SER患者, 在应用强化BFM方案后5年EFS为70.7%± 7.3%。而在预后分析中发现, 治疗前白细胞数量小于50× 109/L的患者5年EFS显著高于白细胞数量在50× 109/L以上的患者, 见图3。
早期的强化治疗有利于那些对诱导化疗出现快速早期缓解的年轻成人ALL患者, 但进一步的第二次间期维持和延迟的强化治疗并不能给该人群带来好处; 本化疗方案已经显示出良好结果, 异基因造血干细胞移植对年轻成人ALL患者的作用可能有限。
年龄16~21岁的年轻成人ALL是相对特殊的一种ALL, 儿科及成人血液科医生均可能对其进行诊治, 但< 18岁的患者常由儿科血液病医生诊治, 18~21岁则常在成人血液科诊治。年轻成人ALL的预后显著差于儿童ALL, 除由于白血病细胞本身的生物学特征、患者/医生的依从性及心理社会因素不同外, 不同的治疗方案可能是影响患者预后的最重要原因之一。
CCG1961研究是美国儿童肿瘤协作组CCG1882的后续研究, CCG1882研究显示缓慢早期骨髓反应(SER, 4药诱导治疗第7天骨髓原始细胞> 25%)的儿童(入组条件:1~9岁的≥ 50× 109/L或10~21岁ALL患者)接受缓解后强化治疗后的预后得到显著改善, 1996年开始的CCG1961研究为随机、多中心、2× 2析因设计, 探讨增加缓解后治疗强度是否能改善1~21岁快速早期骨髓反应(RER, 诱导治疗第7天骨髓原始细胞< 25%)患者的预后以及晚期强化方案中以去甲氧柔红霉素替代柔红霉素是否能使SER患者受益。本评价文献主要分析了262例年轻成人(16~21岁)患者的疗效及其预后因素。
CCG1961研究的患者中, 年轻成人ALL占12.7%(262/2 057), 其中RER 177例、SER 75例、化疗7天未查骨髓10例。RER获缓解患者随机接受标准强度或增加强度的缓解后治疗, 后者含长春新碱(VCR)及左旋门冬酰胺酶(L-asp); SER患者则接受增加强度的缓解后治疗。Ph染色体阳性及中枢神经系统白血病患者不进入随机研究。所有CCG1961 RER接受标准缓解后治疗患者、所有CCG1961 RER接受强化缓解后治疗患者、所有年轻成人患者及RER接受标准缓解后治疗年轻成人患者及RER接受增强缓解后治疗年轻患者的5年EFS分别为72%、81%、71.5%、66.9%及81.8%, 5年OS分别为83%、89%、77.5%、75.6%及83.2%; 年轻成人RER患者接受1或2次维持+晚期强化对EFS无影响(71.1% vs. 77.1%)。16~17岁及18~21岁患者的5年EFS相同(71.4%), 性别、种族、免疫表型等与年轻成人患者的预后无明显相关性。Ph染色体、t(4; 11)、亚二倍体核型(< 44)及高白细胞ALL年轻成人患者预后差, 白细胞> 和< 50× 109/L患者的5年EFS分别为43.9%和75.4%。
该研究的5年EFS高达70%以上, 确认了单纯化疗对于无Ph染色体等高危年轻成人ALL的疗效, 提示异基因造血干细胞移植对大多年轻成人ALL价值有限。此类方案值得在成人血液科推广使用, 以验证其有效性。鉴于一般成人血液科治疗年轻成人的EFS较儿童血液科低20%~30%, 在确认成人血液科采用同类方案同样有效前, 建议年轻成人ALL患者在儿童血液科诊治。
值得一提的是, 由于本研究启动较早, 不足之处是设计时没有考虑包括患者的分子生物学特征、微小残留病灶等重要预后因素。股骨头缺血性坏死在年轻成人患者中发生率较高, 应该进一步探讨防治策略。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|