作者简介:周清和安社娟为并列第一作者。周清(1976-),女,河北徐水人,副主任医师,肿瘤学博士,从事肺癌多学科综合治疗研究;安社娟(1971-),女,河南嵩县人,副研究员,医学博士,从事肺癌的转化性研究。
目的 探讨非小细胞肺癌中血管内皮生长因子受体-2(VEGFR-2)与肿瘤-睾丸抗原XAGE-1b基因表达的相关性。方法 从30例非小细胞肺癌患者肿瘤组织中提取总RNA、RT-PCR反应扩增XAGE-1b基因、定量RT-PCR检测VEGFR-2表达水平,分析二者表达的相关性以及与临床特征的相关性。结果 30例患者中,XAGE-1b表达阳性率为40%,61.1%的腺癌表达XAGE-1b,远高于非腺癌的8.3%(χ2=6.302, P=0.012)。XAGE-1b与VEGFR-2表达水平呈正相关( r=0.546, P=0.002),XAGE-1b阳性患者的VEGFR-2表达水平偏高。多元回归分析显示,病理类型(比值比 0.072,95%可信区间 0.007~0.785, P=0.031)和VEGFR-2表达水平(比值比14.765,95%可信区间1.274~171.144, P=0.031)是XAGE-1b表达的影响因素。XAGE-1b表达阳性与阴性、VEGFR-2表达高与低患者的生存时间差异均无统计学意义(Log-rank P=0.416、 P=0.384)。结论 非小细胞肺癌中VEGFR-2与XAGE-1b基因表达呈正相关,XAGE-1b表达阳性并且VEGFR-2高表达的患者可能是免疫疗法与抗血管生成疗法联合治疗的合适人群。
:Objective To explore the correlation between vascular endothelial growth factor receptor-2 (VEGFR-2) and cancer-testis antigens XAGE-1b gene expressions in non-small cell lung cancer (NSCLC).Methods Tumor tissues were obtained from 30 patients with NSCLC and the total RNA was extracted for RT-PCR. Full-length XAGE-1b gene was amplified by RT-PCR and VEGFR-2 mRNA expression level was evaluated by quantitative real-time PCR. The correlation between VEGFR-2 and XAGE-1b gene expressions and the association between gene expressions and clinical characteristics were analyzed.Results In the 30 tumor tissue specimens, the expression rate of XAGE-1b gene was 40%. XAGE-1b expression was associated with pathology (adencarcinoma vs. non- adencarcinoma: 61.1% vs. 8.3%,χ2=6.302, P=0.012). There was positive correlation between XAGE-1b and VEGFR-2 expressions ( r=0.546, P=0.002). Pathology(OR=0.072,95%CI=0.007~0.785, P=0.031)and VEGFR-2 expression level (OR=14.765,95%CI=1.274~171.144, P=0.031)were influential factors for XAGE-1b expression. There were no significant difference in the overall survival between the patients with positive and negative XAGE-1b or with high level and low level VEGFR-2 (Log-rank P=0.416 and 0.384).Conclusions Patients with NSCLC whose tumor was XAGE-1b positive and VEGFR-2 high expression might be appropriate population for combination therapy of antiangiogenic treatment with immunotherapy.
近年来, 抗血管生成疗法在肺癌、结直肠癌等多种肿瘤中取得喜人成绩[1, 2, 3], 无论是针对血管内皮生长因子(vascular endothelial growth factor, VEGF)的单克隆抗体还是针对VEGF受体(vascular endothelial growth factor receptor, VEGFR)的酪氨酸激酶抑制剂都成为靶向治疗的研究热点。在新生血管形成的过程中, VEGFR-2起着关键的作用, 也是多种抗血管生成药物, 如SU5416、ZD6474和AZD2171的作用靶点[4, 5, 6], 因此, VEGFR-2的表达水平高低、其表达与哪些临床因素相关、表达水平能否预测抗血管生成药物的疗效等一系列问题也成为关注的焦点。
以肿瘤-睾丸抗原(cancer-testis antigens, CTA)负载树突状细胞构建肿瘤疫苗是一种经典的抗肿瘤免疫治疗手段, 本研究团队采用CTA成员之一XAGE-1b蛋白负载树突状细胞体外构建了肺癌疫苗[7], 并报道了非小细胞肺癌(non-small cell lung cancer, NSCLC)患者肺癌组织和正常肺组织的XAGE-1b mRNA表达情况[8]。研究发现, VEGF不仅促进肿瘤组织新生血管的形成、促进肿瘤细胞的生长和转移, 还能够抑制树突状细胞分化和成熟, 诱导免疫耐受, 从而干扰免疫治疗疗效[9, 10]。因此, 抗血管生成疗法与免疫治疗在理论上具有联合增效的可能性。本研究利用既往检测了XAGE-1b表达状况的30例NSCLC患者的mRNA/cDNA标本, 检测这些患者的VEGFR-2表达水平, 探讨XAGE-1b与VEGFR-2表达的相关性, 从而探讨在NSCLC中将抗血管生成疗法与免疫治疗联用的可行性。
采用本课题组既往检测XAGE-1b表达状况的30例NSCLC患者的mRNA/cDNA标本, mRNA提取、质量鉴定以及mRNA逆转录为cDNA的过程和条件见我们的报道[8]。
XAGE-1b表达检测方法见我们的报道[8]。根据GenBank (Accession No.: NM_002253.1)中VEGFR-2序列设计引物和探针, 采用β -actin作为内参。VEGFR-2和β -actin的引物序列、探针序列以及PCR产物长度见表1。
| 表1 扩增VEGFR-2和β -actin的引物及探针序列 |
为建立实时PCR标准曲线, 采用基于特异性引物逆转录PCR扩增VEGFR-2和β -actin, 将扩增子分别克隆入pMD18-T质粒(TaKaRa, 大连), 测序鉴定, 采用A260(Amersham Biosciences GeneQuant, USA)定量标准品DNA, 采用超纯水进行连续稀释至107~101拷贝/μ L, 取1 μ L作为检测样本的定量标准, 每次实时PCR反应时采用新的标准曲线。
在20 μ L反应体系中进行VEGFR-2和内参基因β -actin的定量检测, 体系中包括:TaqMan Universal PCR Master Mix (Applied Biosystems) 10 μ L、每个PCR引物0.3 μ M和探针0.2 μ M, 用超纯水调节总容量至20 μ L, 在ABI Prism 7000 Sequence Detection System (Applied Biosystems)中完成PCR反应。PCR反应条件如下:50° C 2分钟、95° C 10分钟, 然后进行95° C 15秒、60° C 1分钟40个循环。每个样本重复测定两次, 取均值作为定量检测结果, 以内参β -actin 106拷贝对VEGFR-2的拷贝数进行校正, 结果表示为:VEGFR-2拷贝数/106 β -actin拷贝数。统计分析时将数据进行log转换以使其服从正态分布。
采用SPSS 16.0统计软件对数据进行统计分析。在α =0.05的水平下, 应用Spearman相关分析检验XAGE-1b与VEGFR-2 mRNA表达水平的相关性; 采用卡方检验或FISH确切概率法检验XAGE-1b表达与临床因素的关系; 采用t检验或方差分析检验VEGFR-2 mRNA表达水平与临床因素的关系; 在α =0.05的水平下, 采用多元logistic回归分析影响XAGE-1b表达的因素; 单因素生存分析采用Kaplan-Meier法, 并进行Log-rank检验。P< 0.05为有统计学意义标准。
2.1 30例患者一般特征
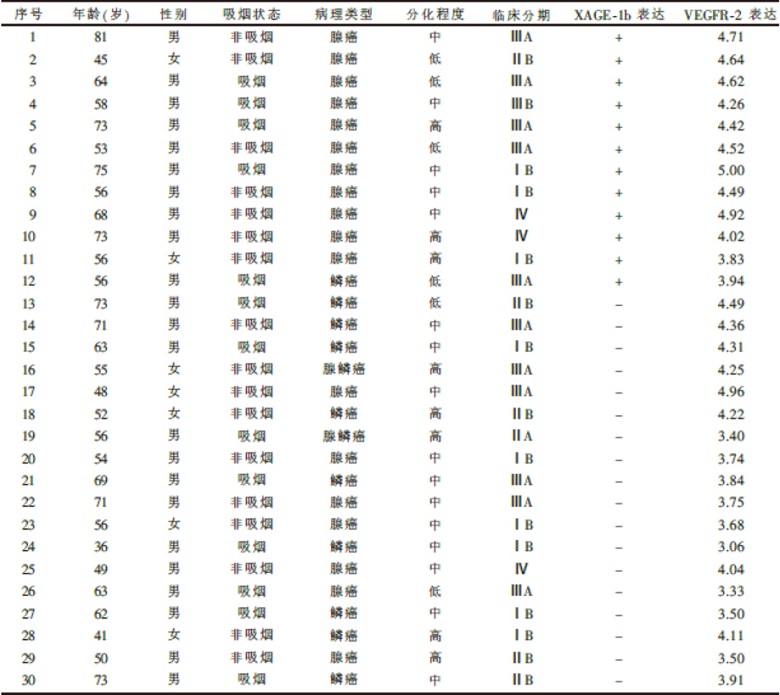
30例患者中位年龄57岁(范围36~81岁), 女7例, 男23例; 吸烟者13例, 非吸烟者17例; 腺癌18例, 鳞癌10例, 腺鳞癌2例; 高、中、低分化分别为8、16和6例; 肿瘤分期为Ⅰ 期9例、Ⅱ 期6例、Ⅲ 期12例和Ⅳ 期3例。详细临床特征见表2。
| 表2 30例患者临床特征和基因表达情况 |
30例患者中, 12例(40%)XAGE-1b表达阳性, 基因表达与患者年龄、性别、吸烟状态、肿瘤分化程度以及临床分期无相关性, 但与病理类型相关:腺癌中XAGE-1b表达阳性率为61.1%(11/18), 明显高于其他病理类型的8.3%(1/12) (χ 2=6.302, P=0.012)。30例患者的VEGFR-2表达水平见表2, 其表达水平与患者年龄、性别、吸烟状态、肿瘤分化程度、临床分期以及病理类型均未见显著相关性。
Spearman相关分析显示, XAGE-1b与VEGFR-2表达水平呈正相关(r=0.546, P=0.002), XAGE-1b阳性患者的VEGFR-2表达水平偏高。在α =0.05的水平下, 将患者临床特征和VEGFR-2表达共同纳入多元logistic回归分析中, 结果显示, 病理类型(比值比=0.072, 95%可信区间0.007~0.785, P=0.031)和VEGFR-2表达水平(比值比=14.765, 95%可信区间1.274~171.144, P=0.031)是XAGE-1b表达的影响因素。
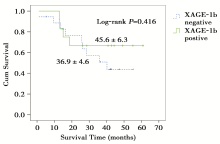
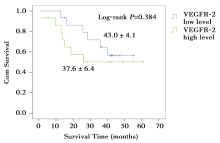
由于死亡事件不足50%, 中位生存时间均未达到, 故采用平均生存时间描述各组患者的生存情况。XAGE-1b表达阳性患者的平均生存时间(45.6± 6.3个月)长于XAGE-1b表达阴性患者的平均生存时间(36.9± 4.6个月), 两组之间差异无统计学意义(P=0.416)(图1)。以既往报道的VEGFR-2表达高低的分界值以4.12为界[13], VEGFR-2高表达患者的平均生存时间(37.6± 6.4个月)低于VEGFR-2低表达患者的平均生存时间(43.0± 4.1个月), 两组之间差异也无统计学意义 (P=0.384)(图2)。
实体瘤新生血管形成对于肿瘤细胞的生长和转移起重要的促进作用, VEGF是目前发现的最为强大的刺激血管内皮细胞增生的因子[11]。VEGF有三个主要受体:Fms样酪氨酸激酶(Fms-like tyrosine, Flt-1, VEGFR-1)、胎儿肝激酶插入区受体( kinase insert domain-containing receptor, KDR, VEGFR-2)和VEGFR-3(Flt-4), 其中VEGFR-2是VEGF的主要功能受体, 具有介导VEGF的刺激血管内皮细胞增生、趋化内皮细胞和增加血管通透性等主要功能[12], 因此, VEGFR-2也成为抗肿瘤治疗的重要靶点。本研究团队既往曾报道了106例NSCLC患者肿瘤组织标本和配对正常肺组织中VEGFR-2 mRNA表达情况[13]:正常肺组织中VEGFR-2表达水平较稳定, 但肿瘤组织中其表达水平有明显的个体差异, 与病理类型、肿瘤分期及患者吸烟状态相关, 并且VEGFR-2表达水平高的患者生存期相对较短。目前大部分针对VEGF或VEGFR的靶向治疗药物尚在研发当中或者正在开展相应临床试验[11], 我们先前的研究也提示, 采用抗血管生成药物贝伐单抗治疗肺癌, 用药后患者血VEGF水平下降可预测贝伐单抗的疗效[14], 但目前尚没有确切证据显示肿瘤组织中VEGFR-2的表达水平能够预测抗血管生成药物的疗效, 但至少VEGFR-2在肿瘤组织中的高表达能够让以其为靶点的酪氨酸激酶抑制剂有的放矢。
本研究定量检测了30例NSCLC患者肿瘤组织中VEGFR-2的表达水平, 结果并未显示VEGFR-2的表达与患者某个或某些临床特征具有显著相关性, 主要原因为样本量较小, 另一方面, 这一结果也再次体现了VEGFR-2在肿瘤组织中的表达水平具有明显的个体差异, 这种差异很可能给以VEGFR-2为靶点的治疗策略带来疗效上的差异, 因此, 未来开展针对VEGFR-2的靶向治疗药物临床研究时, 应该关注VEGFR-2表达的个体差异, 选择有可能获益更多的患者开展有针对性的靶向治疗。
既往研究显示, VEGF不仅促进肿瘤组织新生血管的形成、促进肿瘤细胞的生长和转移, 还能够抑制树突状细胞分化和成熟, 诱导免疫耐受, 从而干扰免疫治疗的疗效[9, 10]。因此, 抗血管生成疗法在阻断VEGF对肿瘤新生血管的刺激作用的同时, 也可以阻断VEGF对免疫活性细胞的抑制作用, 提高免疫治疗的疗效。为了探讨在NSCLC中将抗血管生成疗法与免疫治疗联用的可行性, 本研究检测并分析了免疫治疗靶点XAGE-1b与抗血管生成治疗靶点VEGFR-2表达的相关性, 结果显示, XAGE-1b与VEGFR-2表达水平呈正相关, XAGE-1b阳性患者的VEGFR-2表达水平偏高, 多元logistic回归分析也显示, VEGFR-2表达水平是XAGE-1b表达的影响因素之一。这一结果提示, XAGE-1b表达阳性并且VEGFR-2高表达的患者可能是抗血管生成疗法与免疫疗法联合治疗的合适人群。此外, XAGE-1b表达阳性的患者多为肺腺癌, 而本课题组的前期报道也显示[13], 腺癌中VEGFR-2的表达水平显著高于其他类型非小细胞肺癌, 因此, 在没有条件检测基因表达的情况下, 通过临床因素— — 腺癌初筛两种疗法联合治疗的对象也是可行的。目前尚无类似的CTA与VEGFR-2表达相关性的研究报道, 二者表达相关性的内在机制也不清楚, 本研究在小样本NSCLC患者中对此问题进行了初步探讨, 研究结论有待未来进一步验证。
本研究中, XAGE-1b表达阳性患者的平均生存时间高于XAGE-1b表达阴性患者, VEGFR-2高表达患者的平均生存时间低于VEGFR-2低表达患者, 与本研究团队既往的研究报道结果相似[13], 但由于样本量较小、随访时间尚短, 两组之间差异均无统计学意义。XAGE-1b与VEGFR-2表达的预后价值尚有待进一步确定。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|