| 严红, 1992年自华西医科大学毕业后至今, 一直效力于广东省人民医院, 其间于2002年获医学博士学位。长期从事心血管疾病的临床诊治、冠心病等疾病的介入诊治及相关科研教学等工作, 每年完成冠脉造影术及经皮冠脉支架术近400例。曾在美国Vanderbilt大学医院心脏中心访问、学习一年。主持及主要参与省厅级医学科研基金多项, 所在课题组研究成果曾获得2004年度广东省科技进步三等奖。多年来在《Tissue Engineering》、《中华心血管病杂志》、《中华核医学杂志》、《药物不良反应》、《中华急诊医学》等国内外专业医学杂志上发表论文20余篇。 |
Athyros VG, Tziomalos K, Gossios TD, et al.Safety and efficacy of long-term statin treatment for cardiovascular events in patients with coronary heart disease and abnormal liver tests in the Greek Atorvastatin and Coronary Heart Disease Evaluation (GREACE) study: A post-hoc analysis[J]. Lancet, 2010, 376(9756):1916-1922.
2b。
有关他汀类药物治疗肝病的研究主要是探讨其对肝脏的相关不良反应, 如谷丙转氨酶(alanine transaminase, ALT)和谷草转氨酶(aspartate transaminase, AST)浓度升高的处理。然而, 在一些小型的对非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)导致的转氨酶或γ 谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)活性升高的患者的研究发现, 他汀类药物使用安全并且可改善肝功能。NAFLD是发达国家人群肝功能异常的最常见原因, 其发病率及疾病晚期阶段非酒精性脂肪肝或肝纤维化患病率随年龄、体重指数、甘油三酯(triglycercide, TG)浓度的增高以及患者是否存在糖尿病、高血压或胰岛素抵抗而显著升高。NAFLD患者的全因病死率较普通人群高69%。增高的风险主要源于心血管疾病, 其次为肝脏疾病。非酒精性脂肪肝患者较NAFLD患者的全因病死率甚至更高。由于NAFLD患者的心血管疾病风险增高, 而他汀类药物可预防心血管疾病, 因此在该人群中研究他汀类药物治疗的作用十分重要。
探讨他汀类药物对NAFLD患者治疗的风险-获益比。
• 研究条件:希腊Hippokration大学医院。
• 研究起止时间:1998-2001年。
• 研究方法:GREACE是一项前瞻性、随机、开放标记、意向性治疗、无资助的存活干预研究。
• 研究对象:1 600例年龄< 75岁(58.3± 13.0岁)的冠心病患者(1 248例为男性, 占78%)被纳入研究。血低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)浓度> 2.6 mmol/L且血TG浓度< 4.5 mmol/L。在肝功能异常患者中, 超声诊断为NAFLD及其他原因导致的肝功能异常, 如酗酒(平均酒精摄入量男性> 20 g/d, 女性 > 10 g/d)、慢性乙型肝炎或丙型肝炎、Wilson病及自身免疫性肝炎患者均被剔除。
• 干预措施:所有患者就诊于希腊Hippokration大学医院动脉硬化科, 符合条件的患者将被随机分配接受系统治疗(n=800)并在医院门诊随访, 或者接受普通治疗(n=800)并由心脏专科医生或家庭医生随访。采用随机数字表生成程序4.0版本(Rockville, MD, USA)进行随机分配并实行双盲法。在系统治疗组, 阿托伐他汀的初始剂量为10 mg/d。如果未达到“ 国家胆固醇教育计划” 中设立的LDL-C浓度< 2.6 mmol/L的目标, 则将剂量每6周增高一次, 直到最大80 mg/d, 以达到目标水平。普通治疗组患者根据其诊疗医生的建议进行治疗, 包括改变生活方式(如采用低脂饮食、减肥、锻炼)以及所有必要的药物治疗(包括降脂药)。普通治疗组患者可使用阿托伐他汀。所有患者平均随访3年, 每6个月检查一次。所有参与原研究的患者均包括在此次回顾性分析之内。
1 600例来自GREACE研究的患者中, 313例(20%)存在糖尿病, 其中161/800例(20%)为系统治疗组, 152/800例(19%)为普通治疗组。在这313例患者中, 173例接受他汀类药物治疗(主要为阿托伐他汀n=160, 平均剂量为23 mg/d), 140例未接受他汀类药物治疗。根据“ 国家胆固醇教育计划” 标准, GREACE研究中, 712/1 600例(45%)患者存在代谢综合征[353/800例(44%)为系统治疗组, 359/800例(45%)为普通治疗组], 在这712例患者中, 365例接受他汀类药物治疗(323例为阿托伐他汀, 平均剂量24 mg/d), 347例未接受他汀类药物治疗。多数患者[288/313例(92%)]同时具有糖尿病与代谢综合征。
血清ALT、AST及GGT浓度在基线、治疗第6周(采用剂量滴定推算)及之后的每6个月进行检测。血生化检测采用Olympus AU 560自动分析仪和相应的反应剂(Olympus GmbH, Clare, Ireland)。参考值范围:ALT 10~45 U/L, AST 10~37 U/L, GGT 0~55 U/L。无论患者采用何种治疗方案及基线肝酶水平如何, 血生化检测均在第6周(他汀类药物剂量滴定推算)及随后的每6个月进行。血肌酐浓度采用Jaffé 方法检测(参考值范围为55~115 μ mol/L)。估计的肾小球滤过率(estimated glomeruar filtration rate, eGFR)采用改良的肾脏病配方饮食公式计算[eGFR=175× 血肌酐-1.154× 年龄-0.203(× 0.742如果患者为女性)]。
• 评价指标:研究对肝功能异常患者接受他汀类药物治疗与非他汀类药物治疗的效应进行比较。主要终点事件为任何首次发作的心血管事件— — 全因死亡, 冠心病致死和发作(非致死性心肌梗死、血运重建、不稳定型心绞痛及充血性心力衰竭)或卒中。该风险的降低以与肝功能正常患者接受他汀类药物治疗和非他汀类药物治疗之差相比较来评估。次级终点事件为他汀类药物治疗在肝功能异常患者中对肝功能指标及eGFR的影响。他汀类药物治疗的肝脏相关性不良反应包括ALT或AST活性升高超过正常上限值的3倍。
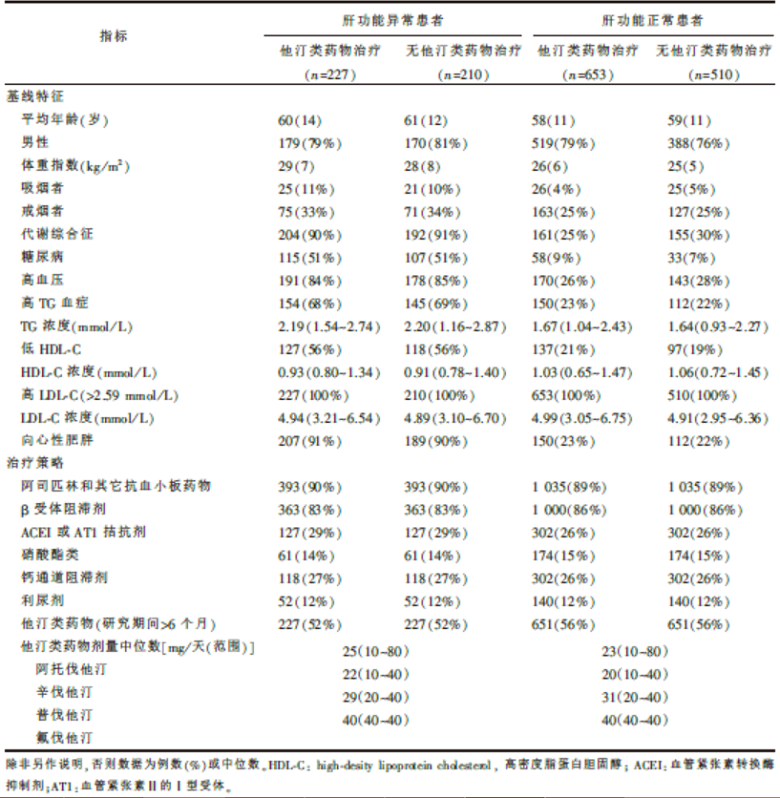
表1列举了根据肝功能及他汀类药物治疗分组的所有研究对象的基线特征。按照预定的研究方案, 肝酶浓度超过正常上限值3倍的患者均未纳入本研究。轻度至中度ALT或AST浓度升高至正常上限值3倍以内的437/1 600例患者在基线进行重点评估(在他汀类药物治疗之前)。这些患者中有396例(91%)存在代谢综合征或糖尿病。总体而言, 396/712例(56%)代谢综合征患者和222/313例(71%)糖尿病患者存在肝功能异常和NAFLD。其余的41例肝功能异常患者体形较瘦并且无代谢综合征或2型糖尿病, 然而存在高甘油三酯血症或高血压(为代谢综合征的两项主要成分)。
肝功能正常患者(n=1 163)与肝功能异常患者(n=437)在他汀类药物治疗的策略上(包括应用他汀类药物)无差异(表1)。
| 表1 根据肝功能及他汀类药物治疗分组的所有研究对象的基线特征及他汀类药物治疗策略 |
接受他汀类药物治疗的肝功能异常患者发生心血管事件的概率低于未接受他汀类药物治疗的患者(相对危险度降低68%, P< 0.000 1, 表2)。这一差异大于所报道的(P=0.007 4)接受他汀类药物治疗的肝功能正常患者[90/653例(14%)发生心血管事件, 即4.6/100(人· 年)]与未接受他汀类药物治疗的肝功能正常患者[117/510例(23%)心血管事件, 即7.6/100(人· 年)]的差异(相对危险度降低39%, P< 0.000 1)。
所有接受他汀类药物治疗的患者(n=880)中有112例(13%)发生心血管事件[4.2/100(人· 年)], 所有未接受他汀类药物治疗的患者(720例)中有180例(25%)发生心血管事件[8.3/100(人· 年)]。他汀类药物治疗组较未接受他汀类药物治疗组相对危险度降低49%, P< 0.000 1。
880例接受他汀类药物治疗的患者中, 10例ALT或AST的浓度升高至正常上限值的3倍以上。在这10例患者中, 有3例患者的肝功能指标由于阿托伐他汀的剂量由80 mg/d(2例患者)和40 mg/d(1例患者)降至10 mg/d而正常化。因此, 仅有7/880例(< 1%)患者由于他汀类药物治疗导致的肝脏相关性不良反应而退出试验。在这7例患者中, 4例接受阿托伐他汀治疗, 3例接受辛伐他汀治疗。阿托伐他汀的平均治疗剂量为40 mg/d, 平均治疗时间为9个月; ALT基线中位浓度为42 U/L(41.5~43.0 U/L), 中断治疗时为98 U/L(97.7~99.0 U/L); AST基线中位浓度为37 U/L(36.0~37.5 U/L), 中断治疗时为146 U/L(139.0~153.0 U/L)。辛伐他汀的平均剂量为33 mg/d, 平均治疗时间为10个月; ALT基线中位浓度为44 U/L(41.8~47.0 U/L), 中断治疗时为109 U/L(102.3~118.0 U/L); AST基线中位浓度为38 U/L(37.3~38.0 U/L), 中断治疗时为115 U/L(146.8~158.0 U/L)。他汀类药物治疗组患者与未接受他汀类药物治疗组患者在退出试验的概率方面差异无统计学意义 [非他汀类药物治疗组3/720例(0.42%), 他汀类药物治疗组7/880例(0.79%), P=0.6]。无论是否接受他汀类药物治疗, 没有1例患者胆红素> 34.2 μ mol/L或碱性磷酸酶浓度高于正常上限值2倍, 也没有1例患者因为肝功能指标异常进行肝脏活检。
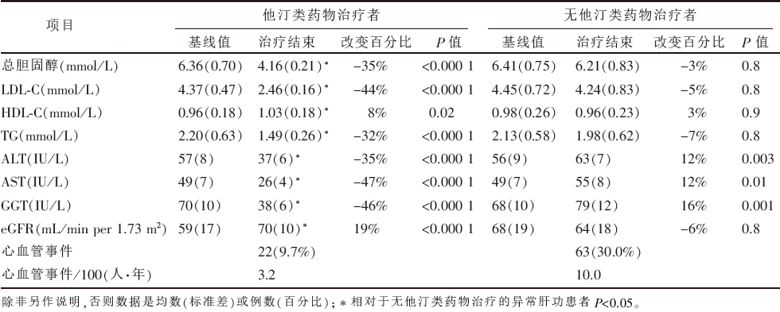
接受他汀类药物治疗的227例ALT、AST及GGT升高的患者中, 他汀类药物治疗期间的肝功能指标有所下降(表2)。使用他汀类药物治疗的肝功能异常患者中, 对于所有检测的指标而言, 只有TG浓度降低与ALT浓度降低相关(r=0.59, P= 0.002)。在使用他汀类药物治疗的肝功能异常患者中, BMI在研究期间无变化, 并且BMI与肝功能指标的改变无相关性。
此外, 389/437例(89%)基线期肝功能异常的患者在3年随访期后ALT、AST及GGT浓度处于正常范围。那些仍有至少一项肝功能指标异常患者的中位LDL-C浓度为2.51 mmol/L(2.49~2.55 mmol/L), 这些患者的中位LDL-C浓度为2.43 mmol/L(2.41~2.55 mmol/L), P=0.7。随访结束时肝功能降至正常的患者(n=389)其他汀类药物中位剂量为阿托伐他汀24 mg/d、辛伐他汀22 mg/d、普伐他汀31 mg/d、氟伐他汀40 mg/d, 然而那些肝功能未转为正常的患者(n=44), 他汀类药物的中位剂量为阿托伐他汀25 mg/d、辛伐他汀24 mg/d、普伐他汀29 mg/d、氟伐他汀40 mg/d。这些患者的他汀类药物中位剂量与研究结束时肝功能正常患者的剂量相似。
基线肝功能异常而未接受他汀类药物治疗的患者(n=210)在随访期间肝功能指标进一步升高(表2)。3年随访期末, 这210例患者的ALT、AST及GGT浓度均高于正常值上限。在8例患者中, 这些酶的浓度甚至高于正常上限值的3倍以上。
接受他汀类药物治疗的患者其eGFR在研究结束时高于未接受他汀类治疗的患者(P< 0.000 1)。肝功能异常的患者中, 他汀类药物治疗组患者的eGFR显著改善, 而未接受他汀类药物治疗组中该指标无明显差异(表2)。
| 表2 GREACE研究中异常肝功患者特征的变化 |
我们对GREACE研究中新发的54例糖尿病患者进行了亚组分析。在这些患者中, 有29/880例(3.2%)患者接受了他汀类药物治疗, 而25/720例(3.5%)在3年中未接受他汀类药物治疗。有18/437例(4.1%)肝功能异常的患者为新发的糖尿病患者[9/227例(4.0%)他汀类治疗组, 9/210例(4.3%)未接受他汀类治疗, P=0.6]; 而36/1163例(3.1%)肝功能正常的患者为新发糖尿病(与肝功能异常患者比较P=0.4)。
轻中度肝功能异常的患者(可能的原因为非酒精性脂肪肝), 他汀类药物治疗可安全地改善肝功能, 并可使心血管疾病死亡率降低。
冠心病和脂代谢异常的患者在他汀类药物长期治疗期间, 其肝脏相关不良反应发生率较低(1.1%), 并且与未接受他汀类药物治疗的患者差异无统计学意义(0.4%, P=0.2)。除此之外, 所有AST或ALT增高至正常上限值3倍以上的接受他汀类药物治疗的患者, 在3年的随访期中肝功能获得了显著的改善。相反, 未接受他汀类药物治疗的肝功能异常患者在随访期间肝功能指标进一步升高。此外, 他汀类药物治疗可使肝功能异常患者的心血管事件风险降低68%(P< 0.000 1)。他汀类药物相关的相对危险度降低幅度在肝功能异常患者较正常患者更显著。因此, 长期他汀类药物治疗(本研究中主要是阿托伐他汀)的风险-收益比值支持他汀类药物的应用, 即使在肝功能中度异常的患者中也如此。
10%的他汀类药物使用者可出现ALT浓度升高, 而且1%的使用者ALT浓度甚至可升至正常上限值的3倍以上。有关他汀类药物导致肝脏疾病的研究证据较少, 多数医生仍不愿意在ALT水平异常的患者中开始应用他汀类药物的治疗。绝大多数ALT水平升高的患者为脂肪肝或非酒精性肝硬化, 因为在发达国家中≥ 20%的患者存在这些情况(即发达国家至少有1/5人群存在脂肪肝或非酒精性肝硬化, 并且其中多数人ALT水平异常)。该研究设计完善、精良、创新性强, 所得到的有关试验初期肝功能异常患者的肝功能检测指标改善的结果与之前发现的丙型肝炎患者应用他汀类药物治疗后肝功能改善的结论相一致[1]。该研究首次显示了在肝功能异常患者中使用他汀类药物降低心血管事件之外的额外益处。目前尚无研究显示存在肝功能检测指标异常的患者拒绝使用他汀类药物治疗的患者比例, 或者有多少比例的患者ALT升高后停止他汀类药物的治疗。有10%~30%需要他汀类药物治疗的患者可能属于以上情况, 并进而拒绝使用他汀类药物治疗。如果这样, 将会有大批存在心血管疾病风险的人群无法进行预防。需要额外考虑的因素是监测肝功能指标的费用。一项研究保守估计他汀类药物使用时的肝功能监测费用为每年100亿美元[2]。
他汀类药物在肝功能异常患者中的显著获益主要归因于NAFLD的存在, 因为酗酒者和其他肝脏疾病已被剔除。NAFLD与代谢综合征、糖尿病有着很大的重叠, 并且被认为是胰岛素抵抗在肝脏的体现。研究发现, 56%的代谢综合征患者和71%的糖尿病患者存在肝功能指标异常。肝功能异常的患者可能较肝功能正常的代谢综合征或糖尿病患者具有更高的心血管疾病风险。重度NAFLD患者— — 定义为高体重指数、高血压、高空腹血糖、高TG及高ALT浓度— — 具有较高的非酒精性脂肪肝、肝纤维化及心血管疾病风险[3]。有研究表明, NAFLD与非酒精性脂肪肝均为心血管疾病的独立危险因素[4]。进行了28年随访的瑞典研究报道了总的病死率在NAFLD患者中增加了56%, 在非酒精性脂肪肝患者中增加了86%。该研究表明心血管疾病是这些患者死亡的主要原因, 而肝外疾病则是次要原因, 第3位死亡原因是肝脏相关的疾病, 其较普通人群有更大的可能性被诊断出来(例如:其肝细胞癌的发生率较普通人群高1 000倍)。同样的死亡原因、同样的死因排序在另一项针对NAFLD患者的长期随访研究中得到证实[5]。因此, 对NAFLD及非酒精性脂肪肝患者更积极的诊断和治疗策略应该被采用。对这类患者而言, 采用他汀类药物治疗是很有希望的策略, 因为他汀类药物的降脂作用和药物多效性可能会阻止NAFLD的恶化, 而且可以降低心血管疾病的新发或复发。
ALT浓度及ALT/AST比值与冠状动脉粥样硬化的严重程度相关。Logistic回归分析显示, ALT/AST比值可预测严重的冠心病(对心血管疾病、代谢综合征的组成因素及C反应蛋白浓度等其他危险因素进行校正的比值比为4.00, 95%可信区间为1.76~9.14)[6]。GGT浓度升高可能与心血管疾病风险的增加有关[7]。GGT可以分解LDL-C的氧化物, 该氧化物参与了动脉硬化的病理过程。由于异常的肝功能检测指标可能与较差的心血管疾病结局相关, 因此肝功能的改善可能会降低心血管事件风险。GREACE工作组之前的研究表明, 在血脂异常患者中, 心脏和肾脏疾病可同时加重, 而他汀类药物治疗可有益于心脏和肾脏。在本分析中, 他汀类药物有益于肾脏功能这一作用得到证实。此外, 不仅是心脏和肾脏疾病, 肝脏疾病也同样可在血脂异常的患者中加重, 并且一个器官的疾病可能影响到另外两个器官。反之, 他汀类药物治疗可能对这三个器官均有益处, 从而导致总的心血管疾病风险降低。
他汀类药物诱发的肝毒性一直是个疑问。大型他汀类药物试验表明治疗组和安慰剂组ALT水平升高的程度和频率均无差异。尽管在他汀类药物使用中确实会发生肝功能异常, 但最终肝功能会恢复正常, 即使是持续使用同一种他汀类药物也如此。过去认为由他汀类药物引发的急性肝功能衰竭, 现在认为其发生率远远低于普通人群中自发性急性肝功能衰竭的发生率。目前尚无一致性的他汀类药物治疗相关的药物损伤性肝活检图片, 并且目前也未见他汀类药物导致肝脏损伤的慢性携带者的报道。因此, 在这种情况下ALT水平升高并不是一种疾病[2]。即使这样, 他汀类药物对于肝功能及肝脏结构有益的潜在机制目前尚不完全明了。对高脂饮食并且发生NAFLD的小鸡进行研究, 结果发现使用阿托伐他汀治疗的动物较未使用该药的动物更少发生肝脂肪变性, 更少发生严重的炎症反应, 并可降低肝脏细胞损伤[8]。他汀类药物在胰岛素抵抗动物模型中似乎可抑制超低密度脂蛋白载脂蛋白B的过度生成, 并且这种作用可改善肝脏对胰岛素的敏感性。在该项研究中可能有绝大多数肝功能异常的患者均存在胰岛素抵抗, 多数肝功能异常患者患有代谢综合征或2型糖尿病(即胰岛素抵抗状态), 而那些无代谢综合征或糖尿病的患者(n=41)也存在代谢综合征的组份(高甘油三酯或高血压)。即使没有完全发展为代谢综合征或2型糖尿病, 这些患者同样存在胰岛素抵抗, 并且可能由于NAFLD而使心血管疾病的风险增高。此外, 阿托伐他汀在有血脂紊乱的非酒精性脂肪肝患者中可降低血糖终末产物浓度。最后, 他汀类药物可通过抑制香叶酰香叶酰化蛋白而降低白介素-6诱导的由肝细胞产生的C反应蛋白[9]。
该研究也存在所有回顾性研究固有的局限性。疑诊为NAFLD的患者数量较少(n=437), 再被分为两组(227例他汀类药物治疗, 210例非他汀类药物治疗), 以至于无法采用“ 后向逐步回归分析” 来精确显示肝功能每降低1 U/L所导致的心血管事件降低幅度。因此, 需要大样本的前瞻性长期研究来解答这一问题。
长期(3年)他汀类药物治疗具有显著的正向获益-风险比。ALT升高作为长期他汀类治疗的不良反应并不常发生。相反, 他汀类药物治疗可显著降低中度肝酶升高(低于正常上限值3倍)患者的ALT、AST及GGT的活性, 这一作用可能是由于NAFLD的存在, 并且这种作用可能用于降低心血管及肝脏相关疾病的患病率和病死率。这种正向的获益-风险比是否可应用于具有更高ALT、AST及GGT活性的患者中仍有待证实。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|