作者简介:马桂芬(1985-),女,四川绵阳人,硕士研究生,从事消化道肿瘤研究。
目的 介绍浅表性食管癌患者的循证处理方案。方法 针对患者的临床问题, 首先在www.guideline.org和www.nccn.org网站上检索了最新的临床指南,然后检索了Ovid(ALL EBM reviews,MEDLINE)(1950年至2011年2月)、Web of Knowledge(1900年至2011年2月)、PubMed (1970年至2011年2月) 和CNKI(1976年至2011年2月)等数据库中有关浅表性食管癌诊断和治疗相关的文献, 并评价其真实性、重要性和适用性以获取最佳证据。结果 共检索到24篇文献,其中包括2篇Cochrane系统评价、2篇Meta分析、2篇指南和1篇随机对照试验。根据现有证据及患者意愿,浅表性食管癌诊断首选胃镜加活组织检查,经内镜黏膜下剥除术对该患者是安全和有效的,不推荐行放疗化疗等辅助疗法。治疗2周后症状明显改善。经过2年的随访,证实所选方案适合患者。结论 应采取多种诊断手段来鉴定早期食管癌。目前的循证医学证据表明对于这类病人行经内镜黏膜下剥除术和内镜随访是一种有效的处理策略。
Objective To formulate an evidence-based practice for the patient with superficial esophageal cancer.Methods After some clinical problems about the diagnosis and treatment of superficial esophageal cancer being proposed, the latest clinical guidelines were found on the websites (www.guideline.org, www.nccn.org), and the Ovid databases(ALL EBM reviews,MEDLINE)(1950 to Feb 2011), Web of Knowledge(1900 to Feb 2011), PubMed (1970 to Feb 2011) and CNKI(1976 to Feb 2011)were searched to collect the relevant evidences. The validity, reliability and feasibility of each study were evaluated to select the current best evidences. Results A total of 24 documents were qualified, including 2 systematic reviews (SRs), 2 meta-analyses, 2 guidelines and 1 randomized controlled trial (RCT). According to the current evidences and the patient’s preference, the diagnosis of esophageal cancer was established by flexible endoscopy and biopsy, and endoscopic submucosal dissection (ESD) technique was safe and effective for this patient.Whereas chemoradiotherapy was not suitable for him. The patient’s symptoms were relieved after two weeks of treatment. Two years of follow-up indicated the practice was suitable for this patient. Conclusions Multiple diagnostic methods should be applied to identify the early stage of esophageal cancer. The current evidences suggest that endoscopic surveillance following ESD therapy is an effective strategy to treat this kind of patients.
较高的食管癌发病率和死亡率仍然是我国面临的问题之一。早期诊断、早期治疗是降低死亡率、提高生活质量的关键。食管癌手术治疗由于改变了胃的正常解剖位置和结构, 术后并发症多, 生活质量差。而内镜治疗创伤小, 并发症少, 生活质量高。随着人们健康意识的加强和内镜诊疗技术的提高, 浅表性食管癌(superficial esophageal cancer, SEC)的发现越来越多, 而早期食管癌(early esophageal cancer, EEC)的处理也从原来的外科手术治疗进入内镜治疗时代。本文通过临床案例就浅表性食管癌患者如何早期诊断, 如何评估淋巴结转移, 如何选择治疗方式, 及如何处理术后并发症等问题进行全面的证据收集和评价, 并针对患者病情制定了循证治疗方案。
患者男性, 54岁, 因“ 上腹部不适半个月” 于2009-03-26入院。患者半月前出现上腹部不适, 胃镜检查提示食管距门齿26 cm处见片状糜烂灶, 自发荧光成像(autofluorescence imaging , AFI)见病灶不染色, 边缘欠清晰; 窄带成像技术染色可见片状病灶; 齿状线清晰, 40 cm过贲门, 黏液湖稍混。胃部和十二指肠无异常。超声胃镜示病灶局限于黏膜层, 呈低回声改变, 周围未探及淋巴结。否认既往高血压、糖尿病史及大量吸烟饮酒史。入院体格检查无特殊。血、尿、粪常规和肝肾功能未见异常, 肿瘤标志物均正常。
患者经内镜检查疑似早期食管癌, 根据PICO原则提出以下临床问题:①怎样诊断浅表性食管癌; ②浅表性食管癌发生淋巴结转移可能性大小; ③如何利用循证医学证据进行肿瘤的分期诊断; ④怎样选择合适的治疗方式; ⑤术前术后是否需要辅助治疗; ⑥如何预防和处理术后相关并发症。
针对患者的临床问题, 首先在www.guideline.org和www.nccn.org网站上检索最新的临床指南, 然后检索了Ovid(ALL EBM reviews包括Cochrane DSR, ACP journal club, DARE, CCTR, CMR, HTA和NHSEED), Ovid MEDLINE (1950年至2011年2月), Web of Knowledge(1900年至2011年2月), PubMed (1970年至2011年2月)和CNKI(1976年至2011年2月)等数据库。
首先查找临床指南、Cochrane图书馆等系统评价、Meta分析、设计良好的随机对照试验, 最后检索临床随机对照研究等。检索词包括:superficial esophageal cancer, early esophageal cancer, early stage or stage Ⅰ in esophageal cancer, lymph node metastasis, stenosis, diagnose, therapy, meta-analysis, systematic review, randomized controlled trial; 浅表性食管癌, 淋巴结转移, 狭窄, 诊断, 治疗, 系统评价, Meta分析, 随机对照试验。
共检索到313篇相关文献, 通过阅读摘要剔除了大部分论证强度弱的病例报道、综述和基础研究, 初步纳入了94篇。再检索并阅读全文, 评价其真实性、正确性、有效性、实用性等指标。其中, Cochrane系统评价, 高质量的Meta分析, 临床指南及严格的多中心大样本RCT属1级证据; 单个小样本RCT属2级证据; 非随机对照, 病例对照研究, 病例观察等为3~5级证据。最终纳入24篇文献, 包括Cochrane系统评价2篇, Meta分析2篇, 2篇指南, 1篇RCT, 这些证据经严格评价和筛选论证强度较高。另有非随机病例对照等研究17篇, 多为回顾性研究, 属于低级别证据, 仅供参考。
SEC是指食管病灶仅限于黏膜层和黏膜下层。其中没有淋巴结转移的才被称为EEC[1]。根据2009年美国癌症联合会(AJCC) 最新第7版TNM分期, 浅表性食管癌又可被定义为局限于上皮内的原位癌(Tis)或上皮内高级别瘤变(high-grade dysplasia, HGD), 或者黏膜固有层或肌层的T1a, 或者浸润到黏膜下层的T1b[1, 2]。因此, EEC的概念包括了Tis、T1a和T1b。SEC的分期见图1。
 | 图1 浅表性食管癌分期[1] |
美国胃肠病学会的临床指南推荐食管癌的诊断靠内镜加活检取得组织学证据[3]。一项前瞻性的双盲对照试验研究表明高分辨染色内镜与带微探头超声内镜(endoscopic ultrasonography, EUS)分期诊断黏膜癌和黏膜下癌的总体正确率分别为83.4%和79.6%, 总的灵敏度为82.9%和79.8%, 平行试验为84%[4]。以往认为卢格氏染色内镜(Lugol chromoendoscopy, LCE)是一种常用的浅表性食管癌的观察方法, 但由于卢格氏液的刺激性使其应用受限。Yoshida等用4种方法记录了25个病损黏膜图片, 再通过25位内镜专家对图片评分, 发现对于平坦/隆起性或者直径大于20 mm的病灶, AFI较白光成像(white light imaging, WLI)评分高, 而对于凹陷性病灶评分明显低, AFI是否优于WLI, 则取决于病灶特点和内镜医师的水平。而窄波成像(narrow band imaging, NBI)的作用跟LCE相似, 较AFI和WLI好[5]。一项多中心RCT表明NBI较WLI可以明显提高早期食管癌诊断的灵敏度(97.2% vs. 55.2%, P< 0.001)和准确度(88.9% vs. 56.5%, P< 0.01), 而特异度无显著性差异(42.1% vs. 63.2%, P=0.33)[6]。另外, 双重对比食管吞钡成像也可用来诊断浅表性食管癌, 检出率82%, 并且可根据隆起部位, 食管的僵直程度, 病灶部位黏膜形态来区分黏膜癌和黏膜下癌[7]。总之, 临床实践中怀疑为早期食管癌的患者不能只凭一两项检查就下结论, 即使多项多次检查均无异常发现, 也应定期复查随访, 以免误诊或漏诊。
早期食管癌的确诊还需要排除淋巴结转移的可能性, 因为这涉及到手术方式的选择和预后评估等。大量证据表明可以通过患者的临床病理特征对有无淋巴结转移进行预测。1篇涉及到32篇文章多地区的系统性综述显示浅表性食管癌淋巴结总转移率为25%, 黏膜癌和黏膜下癌分别为5%和35%[1]。肿瘤浸润深度与淋巴结转移率的关系见表1。
| 表1 肿瘤浸润深度与淋巴结转移率的关系 |
从表1可见肿瘤浸润越深, 淋巴结转移率越高。Fujii等的系统综述还表明鳞癌高于腺癌(28.5% vs. 13.9%, P< 0.001), 低分化、肿瘤直径大于20 mm、非扁平型、淋巴管浸润均跟淋巴结转移明显相关[8]。Kodama等调查了143个中心浅表性食管癌的问卷(n=2 418)显示, 胸中段淋巴结发生率最高(61.3%), 肿瘤直径越大, 淋巴管浸润和转移几率越高[9]。一些证据还表明食管癌的位置不同, 其淋巴结转移部位也不同。另外, Vlachos等[10]在19例食管鳞形细胞癌病人中发现Bcl-2抑凋亡基因跟淋巴结的转移有关, Bcl-X-L跟远处转移有关。可见, 肿瘤的浸润深度、病理类型、肿瘤的位置及一些分子标记可以预测浅表性食管癌的淋巴结转移可能性大小。
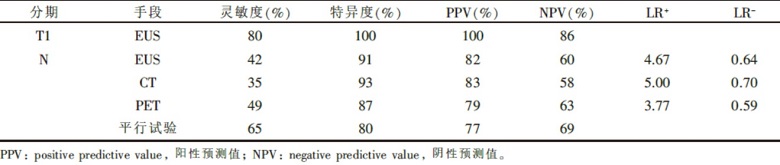
肿瘤的分期诊断对临床处理的选择具有重要的作用。CT、EUS、PET是常用的分期诊断手段。如何经济适当地选择, 如何合理安排检查顺序是临床医师常面临的问题。对于T分期:超声内镜有效, 可以首先选择; N分期:三者都有效, 阳性似然比(positive likelihood ratio, LR+)与阴性似然比(negative likelihood ratio, LR-)相差不大(见表2); M分期:多部位CT有效(胸部、上腹部等), PET有效[11]。 美国胃肠病学会的临床指南表明由于食管癌转移会改变治疗的方式首选推荐CT进行分期诊断, 若CT没有发现远处转移的或者不可切除的肿瘤后, 再进行超声内镜的检查。若EUS怀疑有局部淋巴结转移时, 需进行淋巴结细针穿刺(fine needle aspiration, FNA) 活检, 若这些都没有发现转移性疾病时, 可考虑使用PET-CT, 它对远处转移比较敏感[3]。一项纳入49个研究(n=2 558)的系统评价分析显示EUS诊断T1期食管癌的灵敏度和特异度分别为81.6%和 99.4%。EUS+FNA对食管癌进行N分期时将灵敏度从84.7% 提高到96.7%[12]。
若考虑微创治疗, 排除淋巴结转移的诊断, 可以选择平行试验来提高灵敏度, 阴性结果可排除该诊断, 减少误诊率; 若患者已考虑手术治疗, 为了确诊淋巴结的转移, 可选择系列实验, 提高特异度, 阳性结果可以确诊该诊断。同时要根据患者意愿、经济状况、检查的适应证与禁忌证等因素综合考虑。我们为患者选择了平行试验(EUS和胸部及上腹部增强CT), 结果均为阴性。食管黏膜癌淋巴结转移验前概率为5%[1], 验后比=验前比× LR-(EUS)× LR-(CT)=5%/(1-5%)× 0.64× 0.70=0.024; 验后概率=0.024/(1+0.024)=2.3%, 可见患者胃底淋巴结转移的可能性较低, 没有必要再做昂贵的PET-CT检查。
| 表2 EUS、CT、PET对食管癌分期诊断的评价指标 |
目前食管癌常见的处理方式是外科手术治疗和内镜治疗, 前者的最大问题是术后生活质量差, 后者创伤小, 并发症少, 生活质量高, 缺点是肿瘤残留或者手术本身的并发症如出血和穿孔问题, 需通过内镜再治疗或进一步手术治疗。内镜治疗仅适合于那些肿瘤无浅表淋巴结转移的病人, 尤其是年老或身体虚弱不能胜任手术治疗的患者; 不适合于食管狭窄, 肿瘤浸润较深, 面积较广或已有淋巴结转移的患者。美国临床指南推荐对于浅表的食管肿瘤及高级别瘤变可行内镜下切除, 内镜和外科手术治疗的生存率没有明显差异。内镜下切除术[包括内镜下黏膜切除术(endoscopic mucosal resection, EMR)和ESD]、光动力学治疗(photodynamic therapy, PDT)和热消融术[包括激光、氩离子凝固术(argonplasmacoagulator, APC)及射频消融术(radiofrequencey ablation, RFA)]均可以处理食管黏膜病变, 适当时候联合应用可以提高疗效[13]。1篇系统综述表明目前还没有高质量RCT来比较内镜治疗与外科手术治疗之间疗效的差异, 仅综述了目前关于内镜治疗和外科治疗的一些回顾性研究的特点[14]。国内外大样本病例对照研究均表明内镜治疗与外科手术相比, 患者术后无瘤生存率和食管癌专病死亡率及2年、3年、5年生存率无明显差异[15, 16]。Eguchi等对464例行根治性手术切除的浅表性食管癌分析认为, 肿瘤浸润深度、肿瘤面积、淋巴管和血管浸润、肿瘤分化、细胞核的异形程度, 都决定了EMR术后是否需要行外科手术治疗, 认为EMR仅适合于m1和m2的病人[8, 17]。1篇综述提示对于m3和sm1的病人, 术前怀疑淋巴结转移应采用经胸的食管切除术(transthoracic esophagectomy, TTE)加淋巴结清扫术, 若没有淋巴结转移可以选择EMR、ESD或者胸腔镜手术。对于sm2和sm3, 淋巴结转移概率高, TTE是主要的手段, 并决定是否要进行2区或3区的淋巴结清扫术[1]。总之, 手术方式多样, 要根据病人的临床病理特征进行综合的选择。
浅表性食管癌伴淋巴结转移患者术后是否要进行常规放射化学治疗, 还存在很多争议。NCCN临床指引指出, 对于Tis和T1a期食管肿瘤可行EMR或烧灼处理。对于食管鳞癌不论浸润深度及有无淋巴结转移术后均可观察, 而对于腺癌T1、T2期肿瘤可观察, 若肿瘤浸润更深或出现淋巴结转移时应根据肿瘤具体情况增加放射治疗或者化学治疗[18]。1篇系统综述显示目前没有明确的证据表明术前放疗可以提高患者的生存率[19]。美国国家肿瘤中心数据表明, 使用放疗对总生存期是不利的, 不推荐用于早期食管癌患者[15]。且术前放疗可能增加粘连和ESD手术难度。目前的证据表明浅表性食管鳞癌不推荐辅助治疗。
ESD的并发症包括早期的出血和穿孔、晚期的狭窄、复发或转移等。一项107例浅表性食管鳞形细胞癌患者ESD术后的长期观察发现, 穿孔伴纵隔气肿的发生率为4%, 在632天的中位观察时间里, 食管良性狭窄的发生率为18%, 1位患者术后6个月复发, 2位患者发生远处转移[20]。日本的2项涉及33例及65例ESD的回顾性研究表明, 术后食管狭窄的危险因素可能包括:切除的周长范围大于3/4(危险比44.2)以及组织学浸润的深度达到m2(危险比14.2)[21], 肿瘤范围大于59%以及引起的黏膜缺损大于71%[22]。关于术后狭窄问题的处理, 尚未达成共识, 只有一些病例对照研究。目前认为主要有两种治疗食管狭窄的方法:内镜下球囊扩张(endoscopic ballon dilation, EBD)和可降解支架植入。其中EBD最常用。Ezoe等对41例接受EMR或ESD治疗的患者的对照研究表明, 对于有ESD术后狭窄危险因素的患者, 早期进行预防性EBD可以有效地降低狭窄的发生率(59% vs. 92%)。对于已发生的食管狭窄, 也可减少EBD治疗后的持续时间(29 天 vs. 78 天)[23]。另外, 由聚乳酸(poly-L-lactic acid, PLLA)材料制成的支架具有生物降解性, 支架迁移及由此造成的并发症较少[24]。总之, 关于食管ESD术后并发症预防和处理问题, 还有待高级别的循证医学证据。
目前该患者的分期为T1N0M0, 因此为患者选择了ESD手术, 手术过程未见明显出血, 术后症状明显缓解。术后病理示:鳞形细胞癌, 分化Ⅱ 级, 两侧切缘及基底未见癌累及。根据现有循证医学证据, 该患者ESD术后无需放疗。嘱患者饮食上注意精细饮食, 细嚼慢咽, 并于术后3个月、6个月、12个月、18个月、24个月进行内镜随访。术后3个月随访时内镜下观察到创面愈合良好, 可见白色疤痕, 食管腔轻度狭窄, 经鼻胃镜可以通过。患者并无吞咽困难及不适主诉, 未作扩张或食管支架植入等处理。
胃镜随访2年至今, 食管黏膜未见异常改变, 活检未见异形增生。随访过程中未见淋巴结转移, 无需手术。患者随访中无不适主诉, 营养状态良好, 患者及家属对治疗效果满意。目前随访结果证实该方案的选择是合理的。
通过本病例的成功诊治, 我们进一步认识到循证医学在临床实践中的重要性。在临床实践中应先考虑这些检查对患者是否必要、检查顺序是否合理, 治疗方案是否最适合该患者。这些都须建立在当前所获得的最佳证据和临床专业知识的基础上, 希望以后更多的同行实行床旁循证治疗, 从而使更多的患者受益。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|