作者简介:廖日强(1975-),男,江西龙南人,在读博士研究生,主治医师,主要研究方向为肺癌的多学科综合治疗。
目的 支气管内镜超声引导下经支气管针吸活检(EBUS-TBNA)和经食管超声引导下针吸活检(EUS-FNA)在检查纵隔淋巴结上具有互补性,两者联用可以获得更完整和更准确的纵隔淋巴结分期。通过Meta分析的方法分析两者联用后在诊断肺癌纵隔淋巴结转移上的敏感性和特异性。方法 在MEDLINE数据库进行检索,所有符合联合应用EBUS-TBNA和EUS-FNA诊断肺癌纵隔淋巴结有无转移的研究纳入分析。使用Meta-DiSc软件计算总的敏感性和特异性。结果 共6项研究符合条件纳入分析,研究之间不存在异质性,应用固定效应模型计算,总的敏感性和特异性分别为0.90(95%可信区间0.86~0.94)和0.99(95%可信区间0.98~1.00)。结论 在肺癌纵隔淋巴结分期中联合应用EBUS-TBNA和EUS-FNA具有非常高的敏感性和特异性。
Objective Owing to the complementary reach of endobronchial ultrasound-guided transbronchial needle aspiration (EBUS-TBNA) and transoesophageal ultrasound-guided fine-needle aspiration (EUS-FNA) in assessing different regions of the mediastinum, it suggested that complete and accurate mediastinal staging may be achieved by the combination of both procedures. A systematic review was performed of published studies evaluating combined EBUS-TBNA and EUS-FNA for mediastinal lymph node staging to ascertain the pooled sensitivity and specificity of this investigation.Methods MEDLINE were searched for studies evaluating combined EBUS-TBNA and EUS-FNA accuracy in mediastinal staging with no language restriction. Meta-DiSc software was used to calculate pool sensitivity and specificity.Results Six studies met inclusion criteria and had data suitable for extraction and analysis. Using a fixed effects model, the pooled sensitivity and specificity were 0.90(95%CI 0.86~0.94), 0.99(95%CI 0.98~1.00), respectively.Conclusions Combined EBUS-TBNA and EUS-FNA has excellent overall sensitivity and specificity for mediastinal lymph node staging in patients with lung cancer.
非小细胞肺癌在排除远处转移后, 决定治疗策略和预后的关键在于纵隔淋巴结有无转移。目前纵隔淋巴结分期的金标准仍是纵隔镜检查术[1, 2], 手术需要专科医生在全麻情况下进行, 具有一定的风险性。随着近十几年超声和内窥镜设备的发展, 支气管内镜超声引导下经支气管针吸活检(endobronchial ultrasound-guided transbronchial needle aspiration, EBUS-TBNA)和经食管超声引导下针吸活检(endoscopic ultrasound-guided fine-needle aspiration, EUS-FNA)在国内外大的肿瘤中心和综合医院迅速开展, 其诊断纵隔淋巴结的敏感性和特异性高而且创伤非常小[3, 4, 5], 显示出取代大部分纵隔镜检查术的趋势。EBUS-TBNA和EUS-FNA最适合活检纵隔淋巴结区域并具有互补性, 因此联合应用两种检查可以更加完整地活检纵隔淋巴结, 获得更加准确的纵隔淋巴结分期。目前发表的相关研究样本量不大, 本文通过Meta分析的方法, 探讨联合应用EBUS-TBNA和EUS-FNA在肺癌纵隔淋巴结分期中的价值。
在MEDLINE数据库检索, 并对纳入研究的参考文献进行二次检索, 文献检索时间为2010-10-02, 检索范围为2003年至2010年9月发表的研究。检索词为EBUS、EUS、TBNA、lung neoplasm和lung cancer等。
纳入标准: (1)研究类型为联合应用EBUS-TBNA和EUS-FNA诊断纵隔淋巴结的研究; (2)研究对象为最终经病理学证实的肺癌患者; (3)纵隔淋巴结可有或无肿大; (4)必须能从文献全文或摘要中获得完整的四格表数据以计算敏感性、特异性。
排除标准:(1)单独应用EBUS-TBNA或EUS-FNA的诊断性研究; (2)研究对象为非肺癌患者。
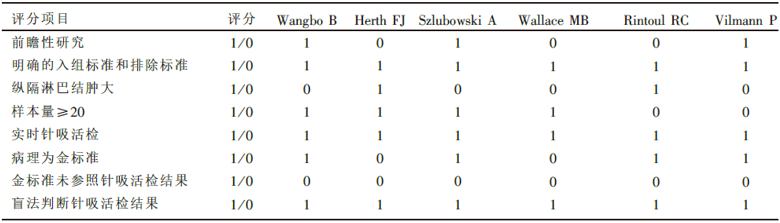
本文参照STARD(standards for reporting studies of diagnostic accuracy)声明关于诊断试验Meta分析的指南[6], 同时结合研究的自身特点制作质量评分量表, 对入选的研究进行质量评价, 如果满足评分标准时计为1分, 如果不满足或研究未说明记为0分。
诊断效能的评价指标包括:敏感性、特异性、诊断优势比(diagnostic odds ratio, DOR)以及综合受试者工作特征(summary receiver operating characteristics, SROC)曲线下面积(area under curve, AUC)。
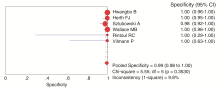
统计学处理:提取纳入研究的诊断四格表[真阳性数(true positive, TP), 假阳性数(false positive, FP), 假阴性数(false negative, FN), 真阴性数(true negative, TN)], 研究中只进行一种检查或者为非肺癌的患者剔除数据, 将数据录入到Meta-DiSc1.4软件, 进行统计学处理。Spearman相关分析检查有无阈值效应(threshold effect)导致的异质性; 对其他异质性、敏感性和特异性采用卡方检验, 如P> 0.05, 且I2≤ 50%时无异质性, 采用固定效应模型, 反之存在异质性, 则采用随机效应模型对诊断效能指标进行汇总处理, 检验水准为α = 0.05。Meta-DiSc1.4软件计算上述诊断效能指标的汇总值及其95%可信区间。
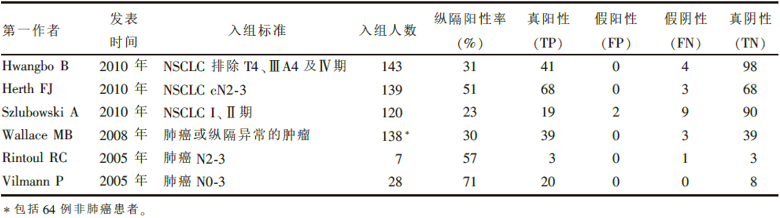
分别由两位作者独立检索, 最初检索后获得相关文献26篇, 经筛选、补充和对入选文献的参考文献二次检索后, 共6篇文献符合纳入标准[7, 8, 9, 10, 11, 12]。6篇文献的基本特征见表1。
| 表1 入选研究的基本特征 |
在入选的研究中一半为前瞻性研究, 另外一半为回顾性研究或未作说明。每项研究均列明入组标准和排除标准, 入选的研究中有2项只入组纵隔淋巴结肿大的患者, 而其它4项研究入组部分或全部纵隔淋巴结无肿大的肺癌患者。在操作的过程中均采用实时超声引导下的针吸活检, 一致性高。基本上每个患者都通过手术或针吸细胞学诊断, 有病理作为金标准, 但个别患者在针吸活检未发现癌细胞后通过随访判断良恶性。所有研究中, 针吸活检前患者均没有纵隔淋巴结的病理诊断, 因此是在盲法下判断针吸活检的结果。总的来说, 入选研究的评分介于4~6分之间, 研究的质量比较高, 见表2。
| 表2 入选研究的质量评分 |
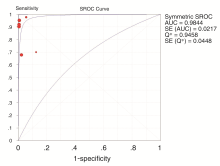
探讨异质性是了解影响精确估计的可能因素和评价合并不同研究的精确度估计是否恰当的关键。首先检验是否存在阈值效应, 当存在阈值效应时, 敏感性与特异性呈负相关, Spearman相关系数为强正相关。在本研究中, Spearman相关系数为 -0.086(P=0.872), 不存在阈值效应。再检验非阈值效应(如入选人群、技术条件等是否引起研究间存在异质性), 由Meta-DiSc软件计算得出Cochran-Q=10.08, P=0.073 1, 表示不存在非阈值效应引起的异质性。
Meta分析结果显示联合应用EBUS-TBNA和EUS-FNA对肺癌纵隔淋巴结的分期具有非常高的诊断效能, 综合的敏感性为90%, 特异性99%, 综合受试者工作特征(SROC)的曲线下面积(AUC)达到0.984 4。与历史数据相比较, 联合EBUS-TBNA 与EUS-FNA的诊断价值明显高于CT和PET, 而略优于单独的EBUS-TBNA或EUS-FNA[3, 4, 5]。
纵隔淋巴结分期的方法包括无创和有创两类, 无创方法有CT、PET或PET-CT等, CT和PET诊断纵隔淋巴结转移的敏感性分别为51%~61%和74%~79%, 特异性为85%和85%~90%[2, 13], 对于CT或PET提示有转移的淋巴结往往需要通过有创的方法进行病理确认。有创的分期方法包括纵隔镜检查术、胸腔镜检查术、经支气管针吸活检以及这十几年发展的微创的支气管内镜超声引导下经支气管针吸活检(EBUS-TBNA)和经食管超声引导下针吸活检(EUS-FNA)。纵隔镜检查术是目前公认的金标准, 敏感性80%, 特异性100%[1]。EBUS-TBNA和EUS-FNA的敏感性、特异性分别为88%~93%、100%[3, 4]和83%、97%[5]。
经颈纵隔镜检查术最佳的活检区域位于气管前方和两旁的病变如第1、2、4组和第7组淋巴结, 对第5组和第6组淋巴结需通过胸骨旁纵隔镜检查术或扩大的经颈纵隔镜检查术活检, 而下纵隔淋巴结如第8组和9组淋巴结以及位于气管后的第3组淋巴结和第7组后部的淋巴结是传统纵隔镜检查的盲区, 也是假阴性的主要原因。另外纵隔镜检查术需专科医生在全麻下进行, 虽然并发症和死亡率较低, 但仍有一定的风险, 而且检查的费用也比较高。
EBUS-TBNA和EUS-FNA都是在超声引导下, 分别经过气管支气管或者食管对其周围的病变例如淋巴结等进行针吸活检。EBUS-TBNA的活检区域与经颈纵隔镜检查术相似, 另外还可以活检第3组和第10、11组的淋巴结, 而对纵隔镜检查往往难以到达的第7组后部的淋巴结, EBUS-TBNA能非常容易地活检。EUS-FNA的活检区域包括第1、2L、4L-9组淋巴结, 对位于下纵隔的淋巴结具有优势, 其局限性是对2R、4R的淋巴结难以活检。因此从EBUS-TBNA和EUS-FNA适宜活检区域来看, 两者具有非常好的互补性, 基本覆盖了肺癌纵隔淋巴结引流区域所有的淋巴结, 达到完全活检的标准[14]。在纳入分析的所有研究中, 联合检查的方法比单独的EBUS-TBNA或者EUS-FNA能发现更多的转移性淋巴结。另外两种检查还可以在表麻+静脉麻醉下进行, 节省费用, 创伤也比纵隔镜更小, 因此有研究者将联合EBUS-TBNA和EUS-FNA的检查称为“ 内科纵隔镜” [15]。
超声支气管镜和食管超声内镜是两套不同的设备, 患者往往需要接受两位经不同技术训练的医生检查。基于两者原理相同, 有研究探讨将超声支气管镜置入食管进行超声引导下经食管针吸活检[7, 8], 即先行EBUS-TBNA, 然后将EBUS置入食管中, 进行EUS-FNA的操作, 并将这种改良的方法命名为EUS-B-FNA。通过此方法可以节省设备的投入和患者的费用, 而且患者不用进行两次检查, 缩短了诊断的时间。当然此种方法存在一定的不足, 例如, EBUS超声探测的角度更窄; 其前端是可弯曲的, 需要一定的压力推开食管壁; 另外EUS-FNA可以活检胸腔外的病变如左肾上腺, 但EBUS-TBNA穿刺针的长度最长只有4 cm, 不能活检此区域。虽然如此, 从发表的研究看, 以EBUS代替EUS进行针吸活检是安全、可行的, 敏感性和特异性同样非常高。
联合EBUS-TBNA和EUS-FNA仍有假阴性, 其主要原因有淋巴结采样误差、较小的转移病灶以及细胞病理学家和操作者经验不足等。快速现场细胞病理学评估(rapid on-site evalution, ROSE)可以进一步提高诊断的准确性。
在所有联合EBUS-TBNA和EUS-FNA的研究中, 除报道1例比较严重的淋巴结脓肿外, 没有其它严重的并发症, 因此EBUS-TBNA联合EUS-FNA是非常安全的。
本Meta分析存在以下问题: (1)所有研究的结果的判读未能独立于金标准, 即针吸阳性者均认为获得病理诊断, 基本不再进行纵隔镜或开胸手术证实, 因此有可能高估特异性。(2)研究的入组条件不完全相同, 有的研究只入组纵隔淋巴结肿大者, 有的只入组没有肿大淋巴结的肺癌患者, 有的研究两者都入组, 另外淋巴结转移的发生率也存在差异, 因此有可能影响诊断的准确性。(3)可能存在发表偏倚。(4)部分研究的样本量小。(5)因为入组的总样本量不足而且未能获得各个患者的资料, 不能进行Meta分析比较联合检查是否优于单独一种检查。
总之, 在肺癌纵隔淋巴结分期中, EBUS-TBNA联合EUS-FNA基本能完成对纵隔淋巴结所有区域的活检, 达到“ 内科纵隔镜” 的目的, 其敏感性和特异性高, 创伤小, 并发症罕见。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|