作者简介:颜新(1977-),男,广西北流人,硕士研究生,从事糖尿病防治研究,现在广西医科大学第三附属医院南宁市第二人民医院工作。
目的 评价类胰高血糖素样肽-1类似物——利拉鲁肽治疗2型糖尿病的疗效与安全性。方法 应用Cochrane 系统评价方法,对Cochrane图书馆的Cochrane对照试验注册数据库、PubMed、EMBASE、The National Reseach Register、 Current Controlled Trials、中国生物医学文献数据库、中国期刊全文数据库、VIP,建库至2011年8月6日间的所有文献进行检索,查找符合纳入标准的随机对照试验进行质量评价,运用RevMan 5.0统计软件对提取的相关数据进行Meta分析。结果 最终纳入8个随机对照试验,共计3 351例患者,并对其疗效和安全性进行了Meta分析,表明利拉鲁肽与对照组相比,能更有效降低糖化血红蛋白[标准化均数差=-5.34,95%可信区间(-6.92,-3.75), P<0.000 01]和空腹血糖[标准化均数差=-0.80,95%可信区间(-0.94,-0.66), P<0.000 01],能减轻体重[标准化均数差=-0.37,95%可信区间(-0.51,-0.22), P<0.000 01],低血糖风险相似[相对危险度=1.2, 95%可信区间(0.55,2.62), P=0.64];利拉鲁肽胃肠道反应更常见,但短暂而轻微。结论 利拉鲁肽作为一种新的肠促胰岛激素类似物,能显著控制血糖、减轻体重,与对照组低血糖风险相似。但其胃肠道反应较常见,程度较轻而短暂。它为2型糖尿病患者提供了一种新的降糖药选择。
Objective To assess the efficacy and safety of GLP-1 analogues — Liraglutide for T2DM.Methods Based on the principles and methods of Cochrane systematic reviews, electronic database searching was performed on search The Cochrane Library, PubMed, EMBASE, The National Research Register, Current Controlled Trials, CBM, CNKI, VIP, and the data from the beginning of the database to June 8th, 2011 were included. Randomized controlled trials(RCT) concerning Liraglutide for T2DM were selected and assessed for the methodological quality, and the extracted data were performed meta-anlysis by statistical software RevMan 5.0.Result Eight RCTs involving 3 351 patients met the inclusion criteria. Compared with control, Liraglutide showed significant positive effects on lowering hemoglobin A1c,FPG. The effect sizes were [SMD=-5.34,95%CI(-6.92,-3.75), P<0.000 01] and [SMD=-0.80,95%CI(-0.94, -0.66), P<0.000 01] respectively. Liraglutide resulted in weight loss[SMD=-0.37, 95%CI(-0.51,-0.22), P<0.000 01]. For side effects Liraglutide had a similar risk of hypoglycemia with control [RR=1.2, 95%CI (0.55,2.62), P=0.64]. Adverse effects(AEs) were reported in included studies, the most of which were gastrointestinal reaction. And these events were mostly slight and transient. It suggested that Liraglutide was safe.Conclusions As a new incretin analogues,Liraglutide is more effective in lowering blood glucose than control. Furthermore, it resulted in weight loss and had similar risk of hypoglycemia. However its gastrointestinal reactions are more common than control which are mostly slight and transient. It offers an alternative option to currently available hypoglycemic agents for patients with T2DM.
类胰高血糖素样肽-1(glucagon like peptide-1, GLP-1)是末段空肠、回肠、结肠的L细胞产生的肠促胰岛素(Incretin), 能根据体内葡萄糖水平的高低, 按需促进胰岛素分泌、抑制胰高血糖素产生, 还能通过抑制胃排空和增加饱腹感来抑制食欲和减少食物的摄入, 并可能增加β 细胞新生和抑制β 细胞凋亡等。近年来, 专家们逐渐认识到肠促胰岛素与2型糖尿病(type 2 diabetes mellitus, T2DM)病理生理机制间的重要作用。有研究显示, 肠促胰岛素通路在2型糖尿病患者中减弱, 故可以此通路为靶点开发新的降糖药物[1]。因天然GLP-1易被二肽基肽酶(second dipeptidyl peptidase, DPP)-Ⅳ 降解并被肾清除, 半衰期很短(< 2分钟)需持续皮下注射才能发挥药理效应[2], 这明显限制了GLP-1的开发价值。因此, 对GLP-1的研究主要集中于开发长效抗降解的GLP-1类似物和DPP-Ⅳ 抑制剂, 与DPP-Ⅳ 抑制剂相比GLP-1激动剂或类似物能够更好地促进胰岛素的分泌来控制血糖, 减少体重; 而DPP-Ⅳ 抑制剂的有益作用有赖于机体内源性的GLP-1水平, 因而它的药理作用较GLP-1类似物的作用弱[3]。因此, GLP-1类似物理论上就可能成为有助于糖尿病治疗达标的更合适选择。
利拉鲁肽(Liraglutide)是长效GLP-1类似物, 目前已开始应用于临床, 此前已经有较多关于利拉鲁肽的临床试验, 但结果不尽相同。本汇总分析根据已发表的随机对照试验(randomized controlled trials, RCT)评价了GLP-1类似物利拉鲁肽治疗成人2型糖尿病患者中的有效性和安全性。
1.1.1 研究类型
比较利拉鲁肽与对照组治疗T2DM的临床RCT, 语种及发表类型不限。
1.1.2 研究对象
年龄18~80岁, 以1999年WHO标准确诊为 T2DM病患者, 非妊娠, 无心、肝、肾功能异常。
1.1.3 干预措施
试验组采用利拉鲁肽单用或联用口服降糖药物(oral hypoglycemic drugs, 缩写为OAD, 如二甲双胍、磺脲类、噻唑烷二酮类); 对照组除使用安慰剂、未使用利拉鲁肽外, 其他治疗措施完全一样。
1.1.4 疗程
至少12周; 因为糖化血红蛋白(HbA1c)反映的是前3个月的平均血糖水平。
1.1.5 结局指标
主要结局指标:①糖化血红蛋白, ②空腹血糖(fasting plasma glucose, FPG), 次要结局指标:①体重, ②低血糖事件, ③其他不良反应。
计算机检索PubMed数据库、EMBASE数据库、Cochrane图书馆临床试验资料库、The National Reseach Register、 Current Controlled Trials、中国生物医学文献数据库、中国期刊全文数据库、VIP, 建库至2011年8月6日的相关文献资料。手工检索中华内分泌代谢杂志(1988年至2011年7月)、中国糖尿病杂志(1988年至2011年7月)。登陆网站www.novonordisk-trials.com 和www.clinicalstudyresults.org 检索已完成未发表的临床试验。检索ADA/EASD(美国糖尿病协会/欧洲糖尿病协会)2010年的会议摘要。其他检索:追查已获全文的参考文献; 与作者和生产厂家联系, 收集未发表的文献(灰色文献)。英文数据库以Liraglutide、NN2211、Incretin为检索词, 中文数据库以利拉鲁肽、肠促胰岛素为检索词。
由两名研究者分别筛选文献和进行文献质量评价、数据提取, 并交叉核对, 不同意见与第三方讨论解决。两名研究者首先阅读文献题目, 再阅读相关文献摘要, 在排除明显不符合纳入标准的试验后, 对可能符合纳入标准的试验阅读全文。按照Cochrane系统评价员手册5.0版推荐的质量评价标准, 并参考吴泰相等[4]2007关于分配隐藏的文献评价纳入研究质量。
采用Cochrane协作网提供的RevMan5.0统计软件进行Meta分析。按照Cochrane Reviewer’ s Handbook 5.0, 二分类变量采用相对危险度(risk ratio, RR), 连续性变量采用标准化均数差(standardized mean difference, SMD), 可信区间 (confidence interval, CI)都规定为95%。各临床试验的异质性检验采用χ 2检验, 若有足够的相似性(P≥ 0.10, I2≤ 50%), 采用固定效应模型进行Meta分析, 如纳入的研究存在异质性(P< 0.10, I2> 50%)则采用随机效应模型进行Meta分析。若各试验提供的数据不能进行Meta分析, 则采用描述性的定性分析。
评估降糖有效性的主要终点指标是利拉鲁肽组HBA1c与基线水平的差值。利拉鲁肽组空腹血糖与基线的差值是次要终点指标。关于安全性, 统计了低血糖和其他不良反应的例数。由于利拉鲁肽的降糖疗效呈剂量依赖性[5], Feinglos、Sten这两个临床Ⅱ 期早期试验结果表明利拉鲁肽< 0.6 mg无降糖效果[6, 7], 故此后的利拉鲁肽研究除了Seino研究(亚洲人种为主, 体重指数较低)都使用≥ 0.6 mg的剂量, 故本研究只纳入大于0.6 mg的数据进行评价分析疗效。 因利拉鲁肽是新药, 评价其低血糖和其他不良反应事件时入选了所有剂量的数据, 以增加统计效力, 力求发现利拉鲁肽组与对照组之间异常事件的差异。
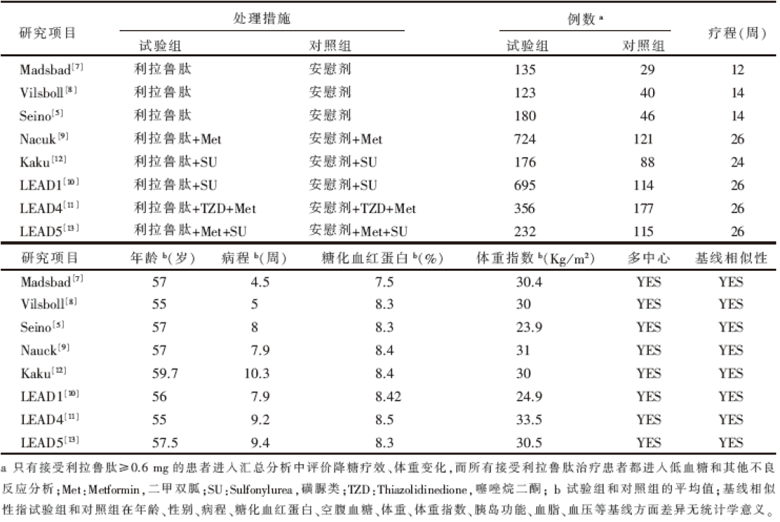
共搜集到相关文献706篇, 在排除综述、 动物实验、 未设置对照、试验时间少于12周、研究对象为健康受试者、重复研究、非安慰剂对照研究后, 仅有8篇RCT[5, 7, 8, 9, 10, 11, 12, 13]研究符合纳入标准。所有的研究地点均在国外, 发表语种均为英文。全部8个研究均已发表, 并能获取全文。所有试验治疗组与对照组的基线平行可比, 均有明确描述, 纳入研究的特征详见表1。
| 表1 纳入研究的特征 |
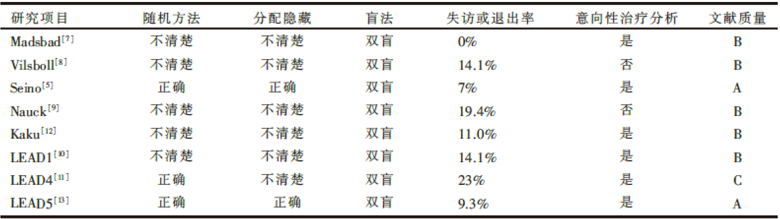
按前面所述的文献质量评价标准, 纳入的文献中Seino[5]和LEAD5的研究质量为A级, LEAD4的研究质量为C级, 其余5个研究[7, 8, 9, 10, 12]的质量为B级。见表2。
| 表2 纳入研究的质量 |
2.3.1 HbA1c
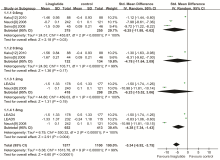
5个研究[5, 9, 11, 12, 13]报告了比较利拉鲁肽与对照组治疗前后HbA1c差值, 异质性检验结果显示I2=100%, P< 0.000 01, 故采用随机效应模型进行数据合并, 按剂量不同分成4个亚组(0.6 mg、0.9 mg、1.2 mg、1.8 mg)以校正部分异质性。Meta分析结果显示两组间差异有统计学意义, 利拉鲁肽组较基线降幅较对照组大[SMD=-5.34, 95%CI(-6.92~-3.75), P< 0.000 01](见图1), 利拉鲁肽组降低HbA1c效果优于对照组。
2.3.2 空腹血糖
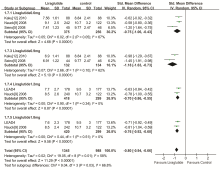
4个研究[5, 9, 11, 12]报告了比较利拉鲁肽与对照组注射治疗后FPG变化情况, 按剂量不同分成4个亚组(0.6 mg、0.9 mg、1.2 mg、1.8 mg), 异质性检验结果显示I2=58%, P=0.01, 故采用随机效应模型进行数据合并。Meta分析结果显示:SMD=-0.80, 95%CI(-0.94, -0.66), P< 0.000 01, 差异有统计学意义(见图2), 故利拉鲁肽组降低FPG效果优于对照组。
2.3.3 体重
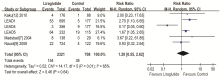
3个研究[9, 11, 13]报告了比较利拉鲁肽与对照组注射治疗前后体重变化情况, 按剂量不同分成3个亚组(0.6 mg、1.2 mg、1.8 mg), 异质性检验结果显示I2=74.7%, P=0.02, 故采用随机效应模型进行数据合并。Meta分析结果显示:SMD=-0.37, 95%CI(-0.51, -0.22), P< 0.000 01, 差异有统计学意义(见图3), 故利拉鲁肽组与对照组相比减轻体重效果好。
2.3.4 低血糖风险
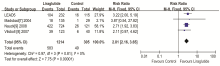
纳入的8个随机对照试验均报道了低血糖事件, Seino[5]、 Vilsboll[8]研究的所有治疗组和对照组均无低血糖事件出现(未纳入Meta分析)。GLP-1类似物很少出现严重的低血糖(需要急救)。Meta分析结果显示: 利拉鲁肽组与对照组相比低血糖的风险相近[RR=1.2, 95%CI(0.55, 2.62), P=0.64](见图4)。
2.3.5 其他不良反应
纳入研究中全部8个研究均报道了不良反应。利拉鲁肽组与对照组相比最常出现的不良反应为胃肠道反应(恶心、呕吐、腹泻), Meta分析结果显示, 利拉鲁肽组较对照组胃肠道反应发生率更多[风险比=2.81, 95%CI (2.16, 3.65), P< 0.000 01](见图5)。有2个研究指出, 胃肠道不适(恶心)主要在前4周内出现, 随时间延长而减轻[7, 11]。有2个试验报告了胰腺炎[9, 10], Nauck[9]研究中利拉鲁肽组和格列美脲组各出现1例, LEAD1研究中利拉鲁肽组出现1例慢性胰腺炎, 这些急性胰腺炎患者症状较轻, 经过约1周短暂治疗后很快康复, 而慢性胰腺炎的患者则坚持完成试验。4个研究观察了心血管事件[5, 7, 8, 11], LEAD1研究利拉鲁肽组和对照组各发现心血管事件8例和4例(两者差异无统计学意义)。利拉鲁肽为GLP-1类似物, 是异种蛋白, 1个研究未发现抗体[7], 1个研究发现有抗体[5], 但没有超过正常水平, 3个研究报道抗体发生率达4%~13% , 但与疗效或不良反应无关[10, 11, 12]。
本系统评价结果显示:①有效性方面, 与对照组和基线值相比, 利拉鲁肽组可明显降低HBA1c、FPG和体重。②安全性方面, 利拉鲁肽低血糖风险和对照组相似; 利拉鲁肽出现胃肠道不良反应较对照组更常见, 但症状轻而短暂, 随时间而减轻; 值得注意的是, 利拉鲁肽组试验过程中出现了1例急性胰腺炎和1例慢性胰腺炎, 格列美脲组出现1例急性胰腺炎, 这些患者病情不重, 治疗后很快康复, 其胰腺炎发病机理及是否与利拉鲁肽有关尚无法确定。最近有学者通过建构胰腺炎大鼠实验模型检验两者相关性, 结果发现GLP-1受体激动剂(利拉鲁肽或Exenatide)可增加胰腺的体积并且选择性改变胰腺炎相关基因的表达, 然而激活或关闭GLP-1信号系统不改变实验性胰腺炎大鼠病变的严重程度[14]。LEAD4研究中利拉鲁肽和对照组均在使用罗格列酮和二甲双胍的基础上发现数例心血管事件, 结果差异无统计学意义。利拉鲁肽作为研究中的新药, 今后尚需开展更多的临床试验继续评价其有效性和安全性, 以确定其在2 型糖尿病治疗中的地位。
因肠促胰岛素的生理作用是增强胰岛素分泌, 故利拉鲁肽降低HbA1c是不足为奇的; 利拉鲁肽与其他胰岛素促泌剂(如磺脲类)不同, 促胰岛素分泌呈葡萄糖依赖性, 故其低血糖风险较低。所以对于胰岛β 细胞功能尚存、有低血糖顾虑的2型糖尿病患者无疑较适合使用此类药物。有研究证实利拉鲁肽的半衰期为11~15小时[15], 这个药代动力学特性为每天一次皮下注射提供了证据。
本系统评价共纳入8个研究(n=3 351例), 全部为多中心的随机对照试验。大多数研究方法学存在一定局限性。从文献质量评价的结果来看, 质量等级多为B级, 大多数文献未报告如何产生随机分配序列、随机方案如何隐藏、盲法如何实施, 提示纳入研究存在选择性偏倚的可能。8个研究均存在退出/失访。由于阴性结果文章往往无法发表, 可能存在一定发表偏倚。由于几乎所有试验的疗程都少于30周, 因而对利拉鲁肽长期有效性和安全性的评价受到限制。从研究人群来看, 5个研究[7, 8, 9, 10, 13]主要为欧美白种人(> 70%)[7, 8, 9, 10, 13], 1个试验主要为欧洲和亚洲人[11], 2个研究主要为亚洲人[5, 12], 人种差异可能对研究结果产生一定的影响。
因为利拉鲁肽采用皮下注射, 部分患者不愿意接受, 故在随机选择研究对象时可能存在选择性偏倚。研究将< 18岁的青少年和> 80岁的老年人、妊娠或哺乳妇女排除在外, 故结论可能不能应用于以上人群。因纳入研究主要由制药企业提供赞助, 潜在的经济利益可能对试验结果产生一定的影响。
本系统评价有2个指标(HbA1c和FPG)的异质性检验结果显示P< 0.1, I2> 50%, 受限于纳入研究的基本情况, 本系统评价对利拉鲁肽疗效的总体趋势进行分析, 结果显示:与对照组相比, 利拉鲁肽组可明显降低HbA1c、FPG, 但此结果受以下因素的影响:①糖化血红蛋白、空腹血糖水平、体重指数、平均年龄及病程基线在各研究间存在差异; ②给药剂量不统一; ③疗程不同; ④3个研究报道了主要指标(HbA1c、FPG), 但未获得进行分析所需要的均数值和标准差, 限制了纳入研究的样本量[5, 9, 11]; ⑤有数个研究联合用药, 不排除药物间存在协同作用, 可能会夸大试验的结果。所以对于本系统评价结果需谨慎看待, 今后有新试验结果时需要定期更新。
利拉鲁肽作为一种新的肠促胰岛激素类似物, 较对照组能显著控制血糖, 减轻体重, 与对照组低血糖风险相似。但其胃肠道反应较常见, 程度较轻而短暂。它为2型糖尿病患者提供了一种新的降糖药选择。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|