| 刘健, 教授、主任医师、硕士生导师, 现任福建省肿瘤医院乳腺内科行政主任、福建省抗癌协会乳腺癌专业委员会副主任委员、中国抗癌协会乳腺癌专业委员会委员、中华预防医学会乳腺学组委员、中国临床肿瘤学会(CSCO)执行委员、中国老年肿瘤专业委员会执行委员、《临床肿瘤学杂志》编委、《欧洲肿瘤年鉴中文版(乳腺癌)》编委。刘健教授还担任福建省政协委员、福建省政协教科文卫体委员会委员、福建省红十字城乡困难居民重特大疾病医疗救助基金监督委员会副主任委员兼专家组专家、民进福建省委员会省直一支部主任、民进福建省科技医卫委员会副主任、民进福建省委员会特邀研究员、民进福建省委员会参政党建设理论研究会成员、福建省百姓健康事业发展促进会常务副会长。刘健教授长期从事肿瘤化疗工作, 擅长乳腺癌诊治。发表论文70余篇, 获学术论文一等奖2项、优秀论文奖3项、二等奖2项、三等奖1项, 获福建省科技进步三等奖2项。 |
Robert NJ, Dié ras V, Glaspy J, et al, RIBBON-1: Randomized, double-blind, placebo-controlled, phase Ⅲ trial of chemotherapy with or without Bevacizumab for first-line treatment of human epidermal growth factor receptor 2-negative, locally recurrent or metastatic breast cancer[J]. J Clin Oncol, 2011, 29(10):1252-1260.
1b。
• 抗血管生成药物-贝伐单抗已被证明在多种实体肿瘤转移性疾病中可以改善预后。
• 前期的临床研究表明, 每周紫杉醇化疗加入了贝伐单抗后对HER2阴性乳腺癌患者的无进展生存有获益, 但在安全性方面略有影响; 贝伐单抗联合多西紫杉醇以及贝伐单抗联合卡培他滨的临床研究也有相似的结论。
• 是否所有的化疗加上贝伐单抗均能使HER2阴性患者获益及其安全性尚有待进一步研究。
比较HER2阴性晚期乳腺癌一线化疗联合贝伐单抗的有效性和安全性是否优于单纯化疗。
• 国际多中心、Ⅲ 期、随机双盲对照试验。
• 研究时间:2005年12月至2007年8月。
• 研究对象:入组标准为年龄≥ 18岁的HER2阴性局部晚期或转移性乳腺癌, 未曾接受化疗(辅助治疗除外), ECOG评分0~1分, 无3度以上放射性毒副作用。
排除标准:HER2阳性; 12个月内进行过辅助或新辅助治疗; 脑转移; 血压高于150/100 mmHg; 不稳定型心绞痛; 心功能Ⅱ 级或更严重的心绞痛; 6个月内有心肌梗塞史; 6个月内有卒中或短暂性缺血史; 明显的外周血管疾病; 出血体质或凝血功能障碍; 6个月内有消化道穿孔或腹腔内脓肿; 之前有无法控制的对单克隆抗体治疗过敏反应史; 严重的未愈合外伤; 器官功能不全; 可切除的局部复发病灶; 5年内有其它恶性疾病; 妊娠。选择蒽环类为化疗药物时, 左心室射血分数必须≥ 50%, 而且之前没有用过蒽环类药物。
• 评价指标:主要终点指标为无进展生存(progression-free survival, PFS), 次要终点指标包括总生存率(overall survival, OS)、1年生存率、客观缓解率(objective response rate, ORR)、疗效持续时间和安全性。
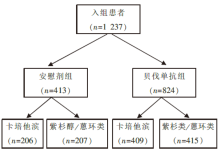
• 干预措施:研究者决定患者的化疗方案, 包括卡培他滨(Cape)、紫杉类(Tax)或含蒽环类(Anthra)方案后, 按2∶ 1的比例将患者随机分为化疗联合贝伐单抗组和单纯化疗组(安慰剂组), 见图1。
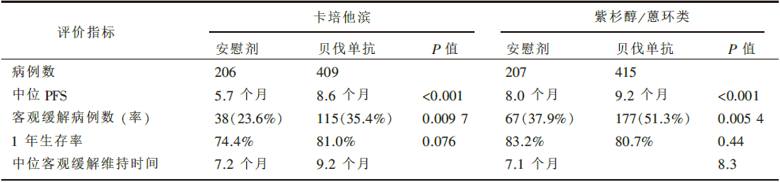
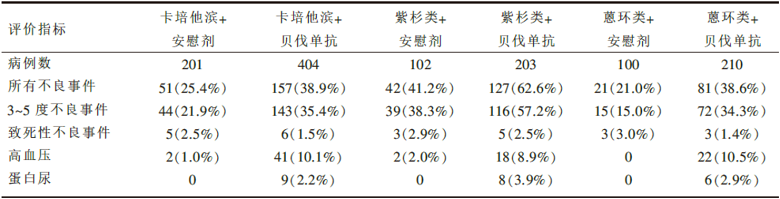
共入组晚期乳腺癌患者1 237例。中位随访时间卡培他滨组为15.6个月, 紫杉醇/蒽环类组为19.2个月。疗效和毒副反应结果见表1和表2。
| 表1 RIBBON-1研究的主要疗效结果 |
| 表2 RIBBON-1研究的毒副反应 |
• 对HER2阴性转移性乳腺癌患者, 一线化疗联合贝伐单抗比单纯化疗疗效更佳;
• 化疗联合贝伐单抗组毒副反应发生率较高, 特别是高血压和蛋白尿。
RIBBON-1研究共入组1 237例18岁以上局部复发或转移性乳腺癌患者, 按照2∶ 1随机分配到化疗+贝伐单抗组和化疗+安慰剂组。患者每3周化疗1次, 接受单药卡培他滨(2 000 mg/m2, d1~d14)或紫杉类为基础方案(白蛋白结合型紫杉醇260 μ mg/m2、多西紫杉醇75 μ mg/m2或100 μ mg/m2)或蒽环类为基础方案[多柔比星或表柔比星联合化疗(多柔比星/环磷酰胺、表柔比星/环磷酰胺、氟尿嘧啶/表柔比星/环磷酰胺、氟尿嘧啶/多柔比星/环磷酰胺)], 每3周1次接受贝伐单抗15 mg/kg或安慰剂治疗。研究的主要终点指标是PFS, 次要终点指标包括OS、1年生存率、客观反应率、疗效持续时间和安全性。根据化疗方案确定两个独立队列人群(接受卡培他滨或紫杉类/蒽环类基础方案化疗的患者)进行平行分析。入组1 237例患者中卡培他滨队列615例, 紫杉类/蒽环类基础方案队列622例, 化疗+贝伐单抗各组较化疗+安慰剂组有更长的中位PFS(卡培他滨队列:PFS从5.7个月延长到8.6个月, 风险比为0.69, 95%可信区间为0.56~0.84, 时序检验P< 0.001; 紫杉类/蒽环类基础方案队列:PFS从8.0个月延长至9.2个月, 风险比为0.64, 95%可信区间为0.52~0.80, 时序检验P< 0.001)。安慰剂组和贝伐单抗组的OS没有显著差异。贝伐单抗的安全性与以往的临床试验研究结果一致。
RIBBON-1研究采用随机双盲安慰剂对照和2∶ 1入组的试验方法, 该方法科学性强且效能高, 样本量较大, 入组人数达到1 237例, 试验同时证实了贝伐单抗联合非紫杉类化方案与联合紫杉类同样在PFS上获益, 这比E2100、AVADO试验更具特色。
但是, RIBBON-1研究美中有不足:首先, 令人遗憾的是贝伐单抗组与安慰剂组的OS差异均无统计学意义(大多数学者认同OS为金标准), 这可能与分析时66%的联合紫杉类/蒽环类药物组患者和70%的联合卡培他滨组患者仍然存活有一定关系。其次, 进展后安慰剂组有一半以上病例交叉进入贝伐单抗治疗, 而贝伐单抗组仅1/3病例继续使用贝伐单抗治疗, 对照组的“ 污染” 可能影响OS。第三, 纳入患者的年龄跨度太大, 从23岁到91岁, 70岁以上的老年患者不确定因素较多。第四, 非卡培他滨组的化疗方案过于繁杂, 方案选择标准难以界定, 受研究者主观影响较大。第五, 贝伐单抗组的严重不良反应发生率高于安慰剂组(高出6%~15%), 高血压、蛋白尿、感觉神经病变和静脉血栓栓塞事件在贝伐单抗组中更多见。最后, 费用的问题, 贝伐单抗+卡培他滨的最佳病例边际成本-效益比率(ICER)为8.2万英镑(约90万元人民币)可获得1个质量调整生命年(QALY), 超出了合理的范围, 贝伐单抗平均每月费用约为3700英镑(约3.7万元人民币)。
贝伐单抗是一种人源化单克隆抗体, 可阻断血管内皮生长因子, 从而减少肿瘤组织的血供。贝伐单抗曾被认为是HER2阴性乳腺癌乃至三阴性乳腺癌的有希望的靶向药物, E2100试验表明贝伐单抗与紫杉醇联合可使HER2阴性乳腺癌患者的中位PFS延长5.5个月, 因此, 贝伐单抗于2008年获得了FDA的快速审批资格。E2100和AVADO这两项大型Ⅲ 期临床研究结果都证实贝伐单抗联合紫杉类作为一线方案治疗HER2 阴性转移性乳腺癌能显著提高肿瘤缓解率并延长PFS, 且安全性较好, RIBBON-1试验证实贝伐单抗联合非紫杉类化疗方案一线治疗HER2 阴性转移性乳腺癌同样在PFS上获益。 E2100、AVADO、RIBBON-1 试验研究结果显示, 贝伐单抗无论与紫杉类或非紫杉类化疗药物联合一线治疗HER2 阴性转移性乳腺癌都能明显延长无进展生存期, 并且患者的耐受性良好, 这三项临床研究结果奠定了贝伐单抗在转移性乳腺癌一线治疗中的重要地位。RIBBON-2试验将贝伐单抗联合不同化疗方案二线治疗HER2 阴性转移性乳腺癌, 结果提示化疗联合贝伐单抗与单纯化疗相比明显延长PFS, 亚组分析显示无论患者的年龄、转移的病灶数目和部位、激素受体状态、一线治疗的至疾病进展时间, HER2 阴性转移性乳腺癌都能从含贝伐单抗的二线治疗中获益。但遗憾的是以上试验数据都未能证明有OS的益处, 美国食品药品管理局认为贝伐单抗风险-收益比不理想, 在2011年11月撤销了贝伐单抗的乳腺癌适应证; 英国临床优化研究所的新指南草案中指出贝伐单抗联合卡培他滨治疗进展性转移性乳腺癌的证据不足, 因此该方案也被英国临床优化研究所否定。尽管如此, 欧洲药品管理局仍然批准贝伐单抗与紫杉醇或卡培他滨联合用于进展性转移性乳腺癌的治疗; 2012年版NCCN一如既往地保留了贝伐单抗与紫杉醇的联合方案。对于贝伐单抗治疗HER2 阴性转移性乳腺癌的价值, 能者见能智者见智, 我们期待有更多的循证医学证据来证实贝伐单抗在乳腺癌治疗中的价值, RIBBON-1试验可能仅仅是贝伐单抗长路漫漫中的一个标识, 但希望也许就在前头, 让我们拭目以待共同见证。
The authors have declared that no competing interests exist.