作者简介:杨惠芳(1986-),女,江西瑞金人,南方医科大学在读硕士研究生,从事皮肤性病学研究。
目的 评价Ustekinumab治疗斑块状银屑病的疗效和安全性。方法 计算机检索中英文数据库,按照制定的标准纳入随机对照试验,手工查找检索到文献的参考文献。由2名研究者独立对各临床试验进行数据提取和质量评估。采用RevMan4.2.2软件进行Meta分析。结果 纳入4项随机对照研究,共计2 437例患者。Meta分析结果显示,Ustekinumab治疗斑块状银屑病12周获得的疗效(三项指标)优于安慰剂,但Ustekinumab 90 mg组和Ustekinumab 45 mg组的疗效无显著差异,相对危险度为0.94(95%可信区间0.82~1.07), P=0.34;治疗28周,在皮损消退方面的疗效Ustekinumab 90 mg组优于Ustekinumab 45 mg组,相对危险度为0.89(95%可信区间0.84~0.95), P=0.000 6,在生活质量改善方面两组无显著差异,相对危险度为0.93(95%可信区间0.85~1.01), P=0.08。最常见的不良反应是上呼吸道感染、鼻咽炎、头痛,Ustekinumab与安慰剂、Ustekinumab两个剂量之间的发生率无显著差异。结果 皮下注射Ustekinumab治疗中重度斑块状银屑病安全有效。
Objective To assess the efficacy and safety of Ustekinumab for plaque psoriasis with meta-analysis.Method Both foreign and Chinese databases were searched to identity randomized controlled trials(RCTs) that reported the efficacy and safety of Ustekinumab for plaque psoriasis. We also searched the references of all primary studies. Two reviewers assessed the quality of each trial and extracted data independently. The Cochrane Collaboration’s RevMan 4.2.2 software was used for statistical analysis.Results A total of 4 RCTs were included, including 2 437 patients. Meta-analysis results suggested that Ustekinumab was superior to placebo for moderate to severe plaque psoriasis at week 12,but there was no significant difference between the two groups of Ustekinumab at week 12(RR=0.94,95%CI 0.82~1.07, P=0.34); at week 28, the Ustekinumab 90 mg group was superior to the Ustekinumab 45 mg group in the skin lesions subsidence(RR=0.89, 95%CI 0.84~0.95, P=0.000 6), but there was no significant difference in the improvement of the life quality(RR=0.93, 95%CI 0.85~1.01, P=0.08). The most common adverse events were upper respiratory tract infection, nasopharyngitis, headache, there were no significant differences between Ustekinumab and placebo, the two groups of Ustekinumab had no significant differences too.Conclusion The present study shows Ustekinumab to be safe and effective for patients with moderate-severe plaque psoriasis.
银屑病是一种常见、易复发、慢性炎症性的皮肤病, 在我国总患病率约为0.123%, 在欧洲的患病率可达1%~2%, 日本为0.2%~1%, 发病年龄以青壮年为多[1]。Ustekinumab是人源化抗IL-12/IL-23的单克隆抗体, 可与IL-12/IL-23的p40亚单位结合, 抑制IL-12/IL-23的生物活性, 达到治疗银屑病的作用, 2009年9月获得美国FDA批准用于中重度斑块状银屑病。为了给临床医生提供Ustekinumab治疗斑块状银屑病的信息, 本文对Ustekinumab的疗效和安全性进行Meta分析。
(1)研究类型:随机对照试验(randomized controlled trial, RCT)。(2)研究对象:临床诊断为斑块状银屑病的患者, 排除点滴状银屑病、脓疱型银屑病和红皮病型银屑病等。(3)干预措施:Ustekinumab与安慰剂对照治疗。(4)测量指标:主要指标为银屑病皮损面积和严重性指数(psoriasis area and severity index, PASI)积分下降≥ 75%的人数所占的比例(以PASI75表示); 次要指标为临床医师的总体评价(physician’ s global assessment, PGA)皮损达到完全清除的人数所占的比例, 以PGA(clear)表示; 皮肤病生活质量指数(dermatology life quality index, DLQI)达到0分或1分(即生活质量不受影响)的人数所占的比例(以 DLQI of 0 or 1表示)以及不良事件。
计算机检索 PubMed、Cochrane图书馆、CBM(中国生物医学文献服务系统)、CNKI(学术文献总库)、万方数据库、维普期刊, 各数据库检索时间均从创建至2011年12月。检索词:Ustekinumab、interleukin-12/23 monoclonal antibody、CNTO-1275、Stelara、psoriasis、randomized controlled trial、银屑病、IL-12/23单克隆抗体、随机对照试验。手工查找检索到文献的参考文献。
由2名评价者独立阅读文献题目和摘要, 必要时阅读全文, 根据预定的纳入标准筛选文献, 如遇分歧, 通过讨论或咨询第三人解决。研究的方法学质量分析按照Jadad量表进行评价, 包括是否正确采用随机分配方法、是否盲法、是否报道失访情况。记分1~5分, 1或2分为低质量研究, 3~5分为高质量研究。并了解在有失访或退出时是否采用意向性治疗分析(intention to treat, ITT)。
采用Cochrane协作网提供的RevMan4.2.2软件进行统计分析。计数资料采用相对危险度(risk ratio, RR)及95%可信区间(confidence interval, CI)表示。用χ 2检验对纳入研究进行异质性检验(P≥ 0.1, I2﹤50%), 如不存在异质性时采用固定效应模型分析; 反之, 采用随机效应模型。根据可能出现异质性的因素及足够的资料进行亚组分析。如异质性源于低质量研究, 则对主要测量指标进行敏感性分析, 即不纳入异质性较大的研究(比如干预措施用法不同)后, 重新进行Meta分析, 并比较两次分析的结果, 探讨该研究对合并效应量的影响程度及结果的可靠性, 如果敏感性分析对Meta分析的结果没有本质性的改变, 其分析结果的可靠性大大增加。用漏斗图分析发表偏倚。
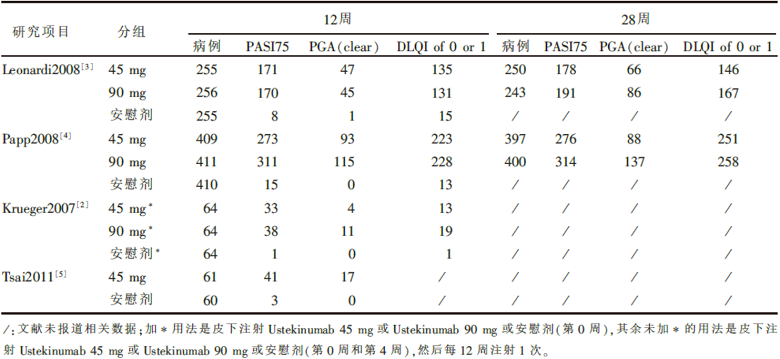
初检到文献303篇, 通过阅读后排除不符合纳入标准的299篇, 最后纳入4篇文献[2, 3, 4, 5], 均为英文文献。共包括病例2 437例, 研究对象为临床诊断中重度斑块状银屑病的患者, 年龄﹥18岁, PASI﹥12分, 皮损面积﹥10%体表面积。3个试验治疗组为Ustekinumab 45 mg或90 mg皮下注射(第0周和第4周), 然后每12周注射1次, 对照组为安慰剂皮下注射[3, 4, 5]。1个试验治疗组为Ustekinumab 45 mg或90 mg皮下注射(第0周), 对照组为安慰剂皮下注射[2]。随机对照阶段的疗程为12周或28周, 4个试验均由Centocor公司赞助[2, 3, 4, 5]。各项纳入研究的基本情况见表1。
| 表 1 纳入研究的基本情况 |
4篇文献均为随机、双盲、对照试验[2, 3, 4, 5], 并描述了随机方法、撤除与退出的数量与理由, Jadad评分均为5分, 为高质量文献, 所有文献采用ITT分析, 所有文献未描述隐蔽分组情况。
2.3.1Ustekinumab皮下注射治疗12周的疗效
2.3.1.1Ustekinumab组与安慰剂组比较
PASI75:4项研究结果间无统计学异质性, 采用固定效应模型进行合并分析。Ustekinumab 45 mg组与安慰剂比较, RR为19.18, 95%CI 13.20~27.88, 差异有统计学意义(P< 0.000 01); Ustekinumab 90 mg组与安慰剂比较RR为21.56, 95%CI 14.51~32.04, 差异有统计学意义(P< 0.000 01), (见图1)。去除Krueger等[2]的研究, 采用固定效应模型对3项研究进行合并分析(敏感性分析)的结果为:Ustekinumab 45 mg组与安慰剂比较, RR为18.65, 95%CI 12.74~27.29, 差异有统计学意义(P< 0.000 01); Ustekinumab 90 mg组与安慰剂比较, RR为20.85, 95%CI 13.92~31.24, 差异仍有统计学意义(P< 0.000 01)。表明治疗12周Ustekinumab获得PASI75的疗效优于安慰剂, 而且两次分析的结果一致, 结果可靠性较高。
PGA(clear): 4项研究结果间无统计学异质性, 采用固定效应模型进行合并分析。Ustekinumab 45 mg组与安慰剂比较(4项研究), RR为64.90, 95%CI 18.69~225.33, 差异有统计学意义(P< 0.000 01); Ustekinumab 90 mg组与安慰剂比较(3项研究), RR为85.78, 95%CI 21.35~344.63, 差异有统计学意义(P< 0.000 01)。表明治疗12周时Ustekinumab获得PGA(clear)的疗效优于安慰剂(见图2)。
DLQI of 0 or 1: 3项研究进行了Ustekinumab组与安慰剂比较, 各研究结果间无统计学异质性, 采用固定效应模型进行合并分析。Ustekinumab 45 mg组与安慰剂比较, RR为12.81, 95%CI 8.91~18.42, 差异有统计学意义(P< 0.000 01); Ustekinumab 90 mg组与安慰剂比较, RR为13.00, 95%CI 9.04~18.69, 差异有统计学意义(P< 0.000 01)。表明治疗12周Ustekinumab获得DLQI of 0 or 1的疗效优于安慰剂(见图3)。
2.3.1.2Ustekinumab 45 mg组与Ustekinumab 90 mg组比较
PASI75:Ustekinumab 45 mg组与Ustekinumab 90 mg组比较, 研究结果间无统计学异质性(P=0.20, I2=38.3%), 采用固定效应模型进行合并分析, 合并效应量RR为0.92, 95%CI 0.86~0.99, 差异有统计学意义(P=0.02, 见图4); 去除Krueger等[2]的研究, 研究结果间无统计学异质性(P=0.08, I2=67.8%), 采用固定效应模型进行合并分析, 合并效应量RR为0.94, 95%CI 0.82~1.07, 差异无统计学意义(P=0.34)。两次分析结果不一致, 对两组获得PASI75的疗效有无显著差异尚不能下结论。
PGA(clear)和DLQI of 0 or 1: Ustekinumab 45 mg组与Ustekinumab 90 mg组比较, 3项研究结果间无统计学异质性, 采用固定效应模型进行合并分析, 合并效应量RR分别为0.85(95%CI 0.70~1.03)和0.99(95%CI 0.89~1.09), 差异均无统计学意义(P=0.09和P=0.78), 表明治疗12周时Ustekinumab两个剂量获得PGA(clear)和DLQI of 0 or 1的疗效无显著差异。
2.3.2Ustekinumab皮下注射治疗28周的疗效
2个试验[3, 4]观察了Ustekinumab 45 mg组和Ustekinumab 90 mg组治疗28周的疗效, 但均未观察安慰剂组28周的疗效。
Ustekinumab 45 mg组与Ustekinumab 90 mg组比较, 对PASI75和PGA(clear)这2个指标, 研究结果间无统计学异质性, 采用固定效应模型进行合并分析, 合并效应量RR分别为0.89(95%CI 0.84~0.95)和0.69(95%CI 0.58~0.82), 差异均有统计学意义(P=0.000 6和P< 0.000 1); 对DLQI of 0 or 1指标, 研究结果间无统计学异质性, 采用固定效应模型进行合并分析, 合并效应量RR为0.93(95%CI 0.85~1.01), 差异无统计学意义(P=0.08)。表明治疗28周Ustekinumab 90 mg组获得PASI75和PGA(clear)的疗效优于Ustekinumab 45 mg组, 但两组间获得DLQI of 0 or 1的疗效无显著差异。
2.3.3不良反应
4个试验均观察了治疗过程中的不良反应[2, 3, 4, 5], Ustekinumab 45 mg组不良反应发生率为53.1%~90%, 感染发生率21.5%~56%, 严重不良反应发生率0.0%~5%, 由于不良反应退出试验的病例共10例(4个试验[2, 3, 4, 5]); Ustekinumab 90 mg组不良反应发生率47.9%~81%, 感染发生率22.4%~44%, 严重不良反应发生率1.2%~2%, 由于不良反应退出试验7例(3个试验[2, 3, 4])。最常见的不良反应是上呼吸道感染、鼻咽炎、头痛, 治疗组和安慰剂间、治疗组2个剂量间的发生率均无显著差异, 严重的不良反应有严重感染、恶性肿瘤、心血管事件等。
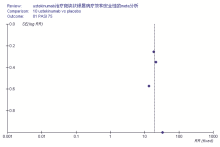
由于本次研究检索的文献均为已发表文献, 根据循证医学对于系统评价的要求, 应当全面收集已发表和未发表的研究报告, 为了检验本次评价是否存在发表性偏倚, 作漏斗图进行分析(见图5)。从漏斗图可以看出图形基本呈对称分布, 存在偏倚的可能性小。
本研究共纳入4个RCT, 共包括病例2 437例, 研究对象是临床诊断为中重度斑块状银屑病的患者, 年龄> 18岁, PASI> 12分, 皮损面积> 10%体表面积。文献质量评价均为高质量。
现有的研究经Meta分析表明, Ustekinumab治疗中重度斑块状银屑病12周获得PASI75、PGA(clear)、DLQI of 0 or 1 的疗效均优于安慰剂, 因Krueger等[2]的研究中Ustekinumab的用法与其余3个试验不同, 去除该试验后, 对主要指标PASI75做敏感性分析, 结果前后一致, 表明Ustekinumab可使银屑病皮损消退, 并改善患者的生活质量; Ustekinumab 45 mg组与90 mg组比较, 治疗12周获得PASI75疗效的结果与敏感性分析的结果不一致, 获得PGA(clear)、DLQI of 0 or 1的疗效两组无显著差异, 表明2个剂量组治疗12周, 对银屑病患者皮损消退和生活质量改善方面的疗效无显著差异; 治疗28周, 90 mg组获得PASI75、PGA(clear)的疗效优于45 mg组, 获得DLQI of 0 or 1 的疗效两组无显著差异, 表明随着疗程的延长, 高剂量组在皮损消退方面的疗效优于低剂量组, 而在改善生活质量方面无显著差异, 在治疗过程中, 生活质量的改善与皮损的消退不平行。本研究显示, 在短时间(如12周)内高剂量(90 mg)的Ustekinumab不一定比低剂量(45 mg)获得更好的疗效, 因此在选择剂量时应衡量可能获得的疗效与可能发生的不良反应, 从而选择较优的治疗方案。
Ustekinumab与安慰剂、Ustekinumab 2个剂量之间的不良反应发生率相似, 最常见的不良反应是上呼吸道感染、鼻咽炎、头痛, 严重的不良反应有严重感染、恶性肿瘤、心血管事件等。对在PHOENIX 1和PHOENIX 2两项研究中参加随机对照阶段的银屑病患者的随访发现, Ustekinumab治疗的患者中恶性肿瘤年发生率(非黑素瘤皮肤恶性肿瘤除外)为0.36%(8/2 249), 与普通人群发生率无差异[6]。Leonardi等[3]和Papp等[4]的研究报道第1次皮下注射Ustekinumab, 2周后起效, 每12周注射1次, 疗效可持续1年半; 在停药后, 银屑病逐渐复发, 表现出暂时的IL-12/IL-23抵抗, 提示疗效的持续需要连续的维持治疗; 停药后再次治疗, 12周后才能再次起效。
本研究纳入的4篇文献, 虽然均为高质量文献, 但文献中均未描述隐蔽分组的情况, 所以可能存在选择性偏倚; 4个试验均由Centocor公司赞助, 原始文献可能存在疗效的阳性偏倚, 所以也可能导致本研究对疗效的评价偏倚。这些偏倚的存在可能影响本研究的可信度。漏斗图分析虽然基本对称, 作为主观判断, 在判定是否存在发表偏倚等问题上存在一定的局限性。而本研究对疗效的评价仅包括12周和28周的结果, 更长期的疗效无报道, 疗效是否能持续不明确。对安全性的评价仅包括12周的结果, 可能罕见的不良反应或者需要长时间才能发生的不良反应不能被发现。本研究的结果需临床医生结合经验和临床实际情况, 慎重选用。尚需进行更多大规模临床试验结果证实本研究结果的可靠性。本研究工作是作者的自主研究, 与Centocor公司无利益冲突。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|