作者简介:葛龙(1988-),男,贵州毕节人,兰州大学基础医学院 2009 级医学检验专业本科生,主要研究方向为循证医学。
目的 评价连接酶链反应技术与培养法诊断沙眼衣原体的准确性。方法 计算机检索PubMed、EMBASE、Cochrane图书馆、中国生物医学文献数据库、中国期刊全文数据库和万方数据库等,收集连接酶链反应诊断沙眼衣原体的试验研究,依据QUADAS质量评价标准评价纳入研究的质量,采用MetaAnalyst软件进行Meta分析。结果 共纳入22个研究,共16 073例受试者。Meta分析结果显示:与诊断沙眼衣原体感染的“金标准”细胞培养相比,连接酶链反应诊断沙眼衣原体感染的合并敏感度、特异度、阳性似然比、阴性似然比、诊断比值比和综合受试者工作特征曲线下面积分别为0.934(95%可信区间0.891~0.961)、0.983(95%可信区间0.972~0.990)、52.88(95%可信区间32.297~86.583)、0.069(95%可信区间0.043~0.110),1 234.549(95%可信区间545.900 ~2 791.925)和0.986。结论 连接酶链反应可作为确诊沙眼衣原体感染的一项新技术,在检测沙眼衣原体感染中有着重要意义。
Objective To evaluate the accuracy of ligase chain reaction and culture for Chlamydia trachomatis test.Methods Systematic and comprehensive literatures were searched in PubMed, EMBASE, The Cochrane Library, Chinese Biomedical Literature Database, China National Knowledge Infrastructure and Wanfang database, et al. The studies of ligase chain reaction diagnosis for Chlamydia trachomatis were included. The quality assessment of diagnostic accuracy studies (QUADAS) items were used to assess the quality of the included studies. The MetaAnalyst software was used to analyze the data.Results A total of 22 studies involving 16 073 participants were included. The results of meta-analysis showed that compared with the cell culture, which used considered as gold standard, the ligase chain reaction indicating a higher level of overall accuracy, the summary sensitivity, specificity, positive likelihood ratio, negative likelihood ratio, diagnostic odds ratio, that the area under the summary receiver operating characteristic (SROC) curve were 0.934(95%CI 0.891~0.961), 0.983(95%CI 0.972~0.990), 52.88(95%CI 32.297~86.583), 0.069(95%CI 0.043~0.110), 1 234.549(95%CI 545.900~2 791.925) and 0.986, respectively.Conclusion The ligase chain could use as a new technology for Chlamydia trachomatis infection diagnosed, and may be of benefit for testing Chlamydia trachomatis infection.
沙眼衣原体(chlamydia trachomatis, CT) 是人类的一种重要病原微生物, 为感染泌尿生殖道、口腔、直肠和眼结膜等黏膜表面的专性细胞内寄生物。CT既可导致性传播疾病, 又可侵犯人眼结膜和角膜, 引起沙眼[1]。然而CT感染常无症状或无特异症状而容易被人们所忽视, 建立一种快速、敏感、特异的检测方法显得非常重要; 目前衣原体的常用诊断方法有直接镜检、细胞培养分离、直接荧光抗体染色等。长期以来, 组织培养是确诊CT感染的“ 金标准” , 但其灵敏度受许多条件影响, 而且繁琐费时, 成本高; 相较而言, 连接酶链反应(ligase chain reaction, LCR)具有敏感、快速和特异的特点, 在检测CT感染中有着重要意义[2]。LCR属于一种探针扩增技术, 是依赖靶核苷酸序列的寡核苷酸探针的连接技术, 这种方法应用4种寡核苷酸探针(即两对互补的引物), 当他们在体外结合到靶序列上以后, 用耐热DNA连接酶将他们连接起来。两条探针被连接上以后, 又可以作为新的模板。由于使用两对引物, LCR比聚合酶链反应(polymerase chain reaction, PCR)具有更高的敏感性和特异性。鉴于此, 本文通过收集LCR检测CT的相关文献, 使用Meta分析的方法定量评价LCR诊断CT感染的价值, 以期为临床上沙眼衣原体的检测提供科学证据。
1.1.1 纳入标准 ①研究类型:LCR与细胞培养比较检测沙眼衣原体的诊断性试验; ②研究对象:CT感染患者或疑似为CT患者, 无年龄、性别及种族限制; ③金标准:细胞培养; ④待评价试验:LCR; ⑤测量指标:合并敏感度(sensitivity, SEN)、合并特异度(specificity, SPE)、合并阳性似然比(positive likelihood ratio, +LR)、合并阴性似然比(negative likelihood ratio, -LR)、合并诊断比值比(diagnostic odds ratio, DOR)、综合受试者工作特征(summary receiver operating characteristic, SROC)曲线下面积(area under the curve, AUC)。
1.1.2 排除标准 ①重复报道; ②动物研究; ③综述性文献; ④非LCR与细胞培养对照检测CT的文献; ⑤数据报道有误或不完整, 无法提取四格表的文献。
以“ chlamydia trachomatis、 CT、 ligase chain reaction、LCR、specificity、sensitivity、diagnosis” 等为检索词检索PubMed、EMBASE、Cochrane图书馆。以“ 沙眼衣原体、CT、连接酶链反应LCR、诊断、敏感度、特异度” 等为检索词检索中国期刊全文数据库、中国生物医学文献数据库、中文科技期刊数据库、万方数据库等。检索策略参考The Bayes Library of Diagnostic Studies and Reviews[3]制订, 检索词分目标疾病、待评价试验、诊断准确性指标三大部分, 并根据具体数据库调整, 所有检索均采用主题词与自由词相结合的方式。所有检索策略都通过多次预检索后确定, 最终检索策略为:(中文)“ 沙眼衣原体” AND “ 连接酶链反应 OR LCR” AND “ 特异度 OR 敏感度 OR 诊断” , (英文)“ chlamydia trachomatis” AND “ Ligase Chain Reactions OR LCR” AND “ Specificity OR Sensitivity OR Diagnosis” 。
两位研究者(葛龙和梁莉)通过交叉核对纳入研究的所有相关文献, 经过EndNote和人工去重筛选, 认真阅读初步筛选后的文献题目和摘要, 排除不符合纳入标准的试验, 对可能符合纳入标准的试验进行全文阅读, 以确定是否真正符合纳入标准, 得到最终资料。对筛选过程中存在分歧和难以确定的文献向第三位研究者咨询解决。对所有不符合纳入标准的文献都需要有确切的排除理由。
按照预先设计的资料提取表格提取资料, 资料提取由两名评价人员分别独立进行, 然后互相复核, 准确无误和意见统一后输入统计软件。资料提取主要包括:作者、年代、国籍、试验方法、纳入样本数、参考标准与此法比较所得结果(敏感度、特异度、优势比、似然比等)。
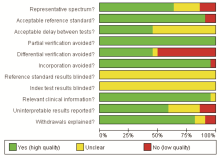
根据Whiting等[4] 制定的QUADAS(quality assessment for diagnostic accuracy studies, 该量表为评价诊断性试验准确性文献质量的工具)11个条目进行质量评价, 并对纳入的每个研究逐条按“ 是” 、“ 否” 、“ 不清楚” 评价。
按不同的诊断方法分组, 采用χ 2检验对各研究DOR结果进行异质性分析(Meta-Disc1.4), 用I2 评估异质性大小, I2< 25%则异质性较小, 25%< I2< 50%则为中等度异质性, I2> 50%则研究结果间存在高度异质性。各诊断试验间异质性较小时, 用MetaAnalyst软件绘制SROC曲线, 并分别计算各种诊断方法的敏感度、特异度、阳性似然比、阴性似然比、诊断性试验比值比、阳性预测值、阴性预测值和SROC曲线下面积, 所有结果均用95%可信区间(confidence interval, CI)表示。如存在异质性, 首先分析异质性来源, 若因不同研究的方法学质量差距过大造成, 可进行敏感性分析。
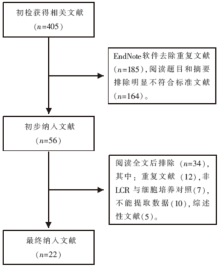
按照检索策略和资料收集方法, 初步搜集到相关文献405篇, 利用EndNote软件去除重复文献后余220篇, 通过阅读文题和摘要排除动物研究、综述及病例报道等不符合标准文献164篇, 对初筛后符合标准的56篇文献进一步阅读全文, 排除未达到纳入标准的文献34篇, 最终纳入22篇文献[2, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25], 其中英文文献13篇[5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17]。详见图1。
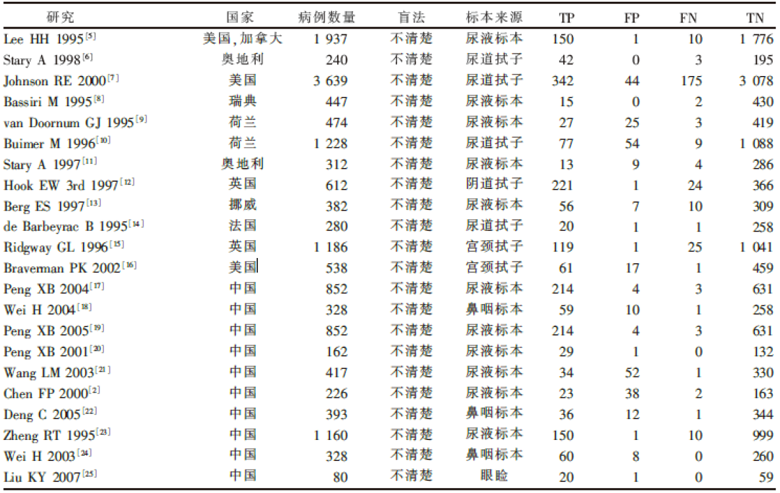
纳入的22篇文献中[2, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25], 共包括16 073例受试者。其中LCR组1 982例, 均为经LCR确诊为CT的患者。对照组13 512例, 包括除CT外的其他病患者(肺炎、性病等)及健康人群。纳入研究均以培养法为“ 金标准” , 采用LCR检测CT, 能够获得真阳性(true positive, TP)、假阴性(false negative, TN)、假阳性(false positive, FP)、真阴性(true negative, TN)、敏感性、特异性, 或报道了其中的部分值可推算出敏感性和特异性, 详见表1。
| 表1 纳入文献的基本特征 |
由2位评价者独立评价文献质量, 如遇分歧, 通过讨论解决。根据QUADAS条目进行质量评价并对纳入的每个研究逐条按“ 是” 、“ 否” 、“ 不清楚” 评价, 详见图2。
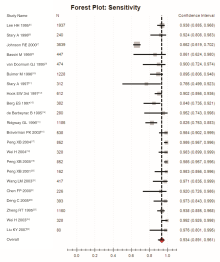
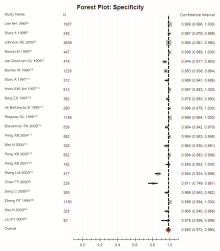
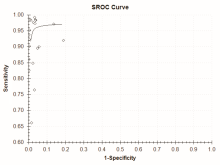
纳入的22个研究[2, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25]间存在高度异质性(P=0.000 0, I2=86.4%), 采用随机效应模型进行Meta分析, 结果显示:LCR诊断CT的SEN合并为0.934(95%CI 0.891~0.961); 见图3, SPE合并为0.983(95%CI 0.972~0.990), 见图4; +LR合并为52.88(95%CI 32.297~86.583), -LR合并为0.069(95%CI 0.043~0.110), DOR合并为1 234.549(95%CI 545.900~ 2 791.925), SROC (AUC) =0.986, Q∗ 值0.972, 见图5。
存在异质性可能与标本不同来源有关, 按照不同来源标本进行亚组分析的结果显示:(1)鼻咽眼睑标本检测结果与金标准对比, 4个研究间未见统计学异质性(P=0.914 9, I2=0.0%), Meta分析结果显示其SEN合并为0.99(95%CI 0.96~1.00), SPE合并为0.97(95%CI 0.95~0.98), +LR合并为29.11(95%CI 20.69~40.96), -LR合并为0.02(95%CI 0.01~0.06), SROC(AUC) =0.993 9。(2)尿液标本检测结果与金标准对比, 11个研究间存在统计学异质性(P=0.000 0, I2=87.8%), Meta分析结果显示其SEN合并为0.95(95%CI 0.94~0.96), SPE合并为0.98(95%CI 0.97~0.98), +LR合并为71.13(95%CI 18.61~271.91), -LR合并为0.07(95%CI 0.04~0.12), SROC(AUC)=0.989 1。(3)尿道拭子和宫颈拭子检测结果与金标准对比, 7个研究间存在统计学异质性(P=0.000 0, I2=85.3%), Meta分析结果显示其SEN合并为0.79(95%CI 0.76~0.81), SPE合并为0.98(95%CI 0.98~0.99), +LR合并为82.34(95%CI 32.54~208.35), -LR合并为0.11(95%CI 0.06~0.22), SROC(AUC)=0.990 7。
快速、准确的非培养CT病原检测法是国内外近年来寻求的热点方法。以往常用的培养法虽是高度特异的, 但不甚灵敏。尿道拭子的培养用于男性, 但采集标本会对病人造成一定的痛苦, 且标本在上皮细胞中仅有少量的衣原体可被取到, 通过培养可能被丢失。在女性中, 沙眼衣原体的培养表明, 有50%~60%被感染的妇女在子宫颈和尿道感染[26]。女性子宫颈拭子标本不含来自感染尿道的微生物, 而尿液样品可以含来自感染尿道的微生物, 还含有来自阴道的伴随微生物。本研究结果表明, LCR法具有高度敏感性、特异性, 与迄今国内外报道检测CT的试验方法相比具有下述优点:(1)快速、经济, 完成检验仅需0.5 天, 一次可检测大量标本。(2)灵敏度高, 漏诊率低, 适合于检测各种发病人群, 包括早期感染和无症状的病原携带者。(3)重复性好, 其结果与操作者经验等主观因素无关。(4)特异性强, 只要引物设计合理, 严格标准操作程序, 避免积累性污染, 假阳性是可以避免的[27]。
在国外, LCR在CT的检测上已经得到广泛应用, 而在我国刚处于起步[2, 24, 28]; 本系统评价纳入了22个与细胞培养法比较、以LCR作为诊断CT的试验研究, 其综合评价结果显示:LCR检测CT的SEN合并为93.4%, 说明漏诊率低, 仅为6.6%; 其SPE合并为98.3%, 说明误诊率为1.7%; + LR合并为52.88, 提示LCR为阳性时, 其疑似病例为CT的可能性大; -LR合并为0.069, 提示LCR为阴性时, 排除疑似病例CT的可能性较大。SROC AUC 为0.986(根据SROC AUC 越接近1.0, 诊断效能越高, 越接近0.5, 诊断效能越低[28]), 认为其诊断效能高; LCR检测CT感染的优越性明显。由纳入22个研究的基本特征和异质性分析可知, 纳入的研究因检测标本的不同其敏感度、特异度等各不相同; 22个研究背景来源于8个国家, 由于各国之间诊断技能和试验水平的差异, 会对本研究的数据合并产生偏倚。
本系统评价的局限性:①由于多数纳入研究未明确说明病例谱是否包含了各种病例及易混淆的疾病病例, 同时未对纳入研究对象的特征、试验方法、质量控制、测量指标等进行详细描述和说明, 大部分纳入文献的研究对象代表性有限, 均未对试验所需样本量进行估计, 并且在测量结果时没有采用盲法, 存在测量偏倚的可能性。②研究纳入文献的全过程不够详细, 比如初步从各个数据库检索出多少文献没有记录; 在进行初步去重等步骤时没有详细记录每一步去重后所纳入文献情况。③本系统评价以细胞培养作为金标准, 而培养法的阳性率本来就比较低, 对取材、送检次数、培养方法等都应有较严格的要求, 以此低灵敏度的试验方法作为参考标准, 或许不能充分地表明连接酶链反应诊断沙眼衣原体的诊断价值。
因此, 限于纳入研究的方法学和实施质量以及诊断试验报告质量等方面的局限性, 建议尽量采用诊断性试验报告标准(standards for reporting of diagnostic accuracy, STARD), 提高诊断性试验的报告质量, 使诊断性试验的结果更准确, 更有利于临床决策[29]; 除此之外, 诊断性试验和对照试验应尽量同步进行, 在进行诊断时应做到“ 盲法” 评估。
综上所述, LCR可作为确诊CT的方法之一, 与高特异性但不甚灵敏的培养法相比具有特异性强、灵敏度高、漏诊率低的特点。因此, 相较细胞培养法, LCR检测CT具有更高的诊断价值。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|