作者简介:安社娟与陈志红并列第一作者。安社娟(1971-),女,河南嵩县人,医学博士,副研究员,主要研究方向为肿瘤的转化医学;陈志红(1969-),女,广东台山人,医学硕士,副主任技师,主要研究方向为肿瘤的分子生物学。
目的探讨肺癌细胞株中层粘连蛋白5(LN5)5′非翻译区多态性与其表达水平的关系。方法 应用测序及实时定量PCR方法检测12株肺癌细胞株中LN5 5′非翻译区多态性和LN5基因mRNA表达水平,分析相互之间的关系。结果 LN5 5′非翻译区-183G/A中GA基因型的LN5 mRNA表达水平明显高于GG基因型( t=7.136, P<0.001)。本研究中尚未发现LN5 基因-6C/A和-89A/G多态性位点与其mRNA表达的相关性。结论 本研究提示LN5启动子区-183G/A多态性位点具有转录调控功能,为进一步的机制探讨提供了依据。
Objective To explore the relationships between the polymorphisms in the 5′-UTR region of laminin 5 (LN5) and the expression level in lung cancer cell lines.Methods The polymorphisms of LN5 and the mRNA expression levels in 12 lung cancer cell lines were detected, using sequencing and real-time PCR methods, respectively, the relationships between them were analyzed.Results Cell lines with GA genotype of -183G/A polymorphisms have a higher mRNA expression level of LN5 than the cell lines with GG genotype ( t= 7.136, P<0.001). No relationships of -6C/A and -89A/G polymorphisms and the mRNA expression levels were found in this study.Conclusions This study suggestes that -183G/A polymorphisms of LN5 gene maybe regulate the transcriptional level, and these results provide the basic evidence for the further mechanism study.
肺癌是当今全球最常见的恶性肿瘤之一, 居我国城市恶性肿瘤死亡率和发病率之首, 其5年生存率低于15%。大部分的肺癌患者发现时已属晚期, 失去手术机会, 尽管新的放疗方案及化疗药物改善了肺癌的治疗状况, 但总体来看效果欠佳, 且毒性大。近几年发展较快的靶向药物也仅对某些具有特殊基因变化的患者有效[1, 2]。因此, 对肺癌的发生发展机制, 包括遗传机制特别是在肺癌的发生发展中具有重要作用的基因多态性的研究可能对肺癌的早期诊断和个体化治疗具有重要意义。
层粘连蛋白(Laminins, LNs)是含有一条α 重链和两条β 和γ 轻链的糖蛋白家族, 是基底膜的重要组成成份, 在细胞分化、粘附和迁移中起重要作用。LN5 γ 2链是基质金属蛋白酶2的特异靶分子, 其降解对肿瘤侵袭和组织重构期间的细胞迁移起关键作用[3, 4]。本课题组的一项研究发现:LN5 γ 2链基因5′ -UTR区多态性可能与抗血管药物Avastin的毒性相关[5]。因此, 我们推测, 这些多态性可能具有某种功能, 但这方面的研究尚未见报道。因此本研究拟利用肺癌细胞株, 分析这些不同的肺癌细胞株LN5 γ 2链基因5′ -UTR区多态性与LN5基因表达水平的关系, 为进一步的机制探讨和肺癌的个体化靶向治疗方法提供依据。
12株肺癌细胞株均为本实验室保存的细胞株, 相关信息如下:A549、H1299、SPCA-1为肺腺癌细胞株, PCL3、H460为大细胞肺癌细胞株, L78为肺鳞癌细胞株, GLCI 001来自于肺腺癌患者腹水, GLCI 002、GLCI 003、GLCI 004、GLCI 005、GLCI 006细胞株来自于肺腺癌患者胸水。细胞株置常规RPMI-1640 (Gibco, 美国)培养基、10%胎牛血清、1%青链霉素、37℃、5% CO2培养箱培养。
细胞株DNA提取采用通用DNA提取试剂盒(TaKaRa, Dalian, China), 操作均按试剂盒说明书进行。应用Gibco BRL公司Trizol试剂按试剂盒说明书提取RNA。用核酸蛋白定量仪定量、分析纯度, 1%琼脂糖凝胶电泳分析完整性。取1 μ g 检验合格的RNA以AMV反转录酶(TaKaRa公司)20 μ L体系进行cDNA的合成, 按试剂盒说明书操作。合成的cDNA存于-80℃冰箱以进行下一步的定量PCR反应。
LN5启动子区基因多态性检测按课题组以前建立的PCR和测序的方法进行[5], 简述如下:PCR扩增应用2× Taq Platinum PCR Master Mix (天根公司, 北京)进行, LN5启动子区扩增引物据GenBank (Accession No.NM_005562)序列设计, 序列如下:正向引物5′ -AGTGCGCTATGATGGTGCCATTG-3′ , 反向引物 5′ -CAGGGCTGAGATGTTTCCTTGTGG-3′ 。扩增产物长度899 bp。PCR 反应条件:94° C、3 min, 94℃、30 s, 69℃、30 s, 72℃、1 min, 30个循环; 72℃、5 min, 所有PCR产物均经1%琼脂糖凝胶电泳检测特异性并经凝胶纯化。纯化产物经BigDye Terminator v3.1 Cycle Sequencing Kit(Applied Biosystems公司)反应, 以ABI PRISM 3730 Genetic Analyzer (Applied Biosystems公司)测序。
引物和探针的设计和合成, 定量PCR标准品的制作, 定量PCR 反应等方法按课题组以前建立的方法[6], 简述如下:从GenBank下载LN5 γ 2链基因序列(登录号:NM_005562), 按AB公司TaqMan分析建议的50~150 bp最佳扩增长度设计引物, 为排除DNA污染对研究的干扰作用, 上下游引物序列设计位于不同的外显子内。以β -actin为内参, 同样设计引物和探针。定量PCR标准品的制作:取以上步骤合成的1 μ L的cDNA分别用LN5 γ 2链基因和内参β -actin特异性引物以Taq酶体系合成目标片段, 将目标片段克隆入TA载体, 转化感受态菌, 提质粒, 进行PCR和测序验证为目标片段, 将验证为目标片段的质粒作为标准品, 定量后分装存于-20℃冰箱备用。每次定量PCR时新鲜倍比稀释用于标准曲线的制备。定量PCR:应用Applied Biosystems公司的TaqMan Universal PCR Master 试剂盒20 μ L体系:10 μ L master mix, 0.3 μ M上、下游PCR 引物, 0.2 μ M探针, 超纯水补充体积至20 μ L。仪器为Applied Biosystems 公司的ABI Prism 7000 Sequence Detection System。PCR 条件如下: 50℃、 2 min, 95℃、10 min, 40个循环; 95℃、15秒, 60℃、1分钟。每一次反应包括没有模板的阴性对照。目标基因以每107的β -actin内参校准。实验至少重复一次, 取均值用于统计分析。
为使定量PCR数值服从正态分布, 将定量PCR数值进行对数转换。LN5多态性和LN5表达水平的关系, 三组间差异分析采用单因素方差分析, 两组之间采用t检验, P< 0.05为统计学检验水准。
所提总RNA的A260/A280介于1.8~2.1之间, 1%琼脂糖凝胶电泳可见清晰的28S及18S 条带, 比值约为1.5~2.5∶ 1, 说明其纯度及完整性良好。实时定量PCR标准品均经测序验证并经GenBank BLASTn比较为正确序列, 标准曲线R2大于0.99, 最低检出限为每反应10个拷贝。
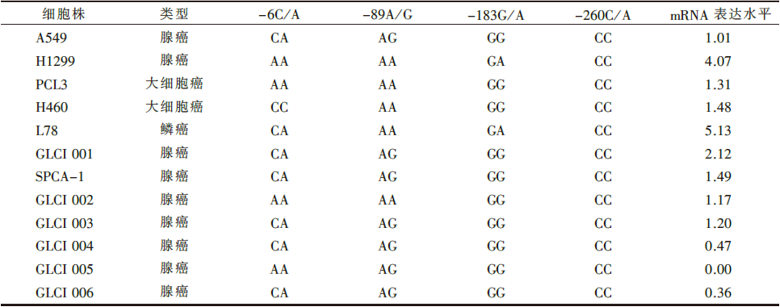
我们成功地检测到了所研究的12株肺癌细胞株中LN5启动子区的-6C/A、-89A/G、-183G/A、 -260C/A 等位点多态性。-260C/A均为CC, 其他各位点结果见表1。
| 表1 肺癌细胞株中LN5启动子区多态性检测结果及mRNA表达水平 |
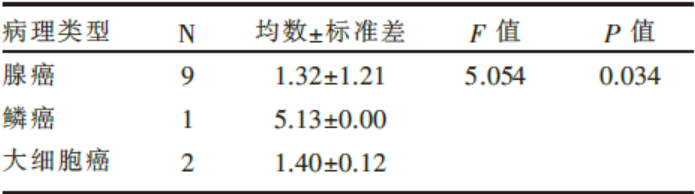
在检测的12株肺癌细胞株中, 除1株GLCI 005为阴性表达外, 其余均有不同程度的表达(表1)。我们采用单因素方差分析方法分析了腺癌、鳞癌、大细胞肺癌三组之间的表达水平, 差异具有明显的统计学意义(F=5.054, P=0.034, 见表2)。
| 表2 不同病理类型肺癌细胞株LN5基因的mRNA表达水平 |
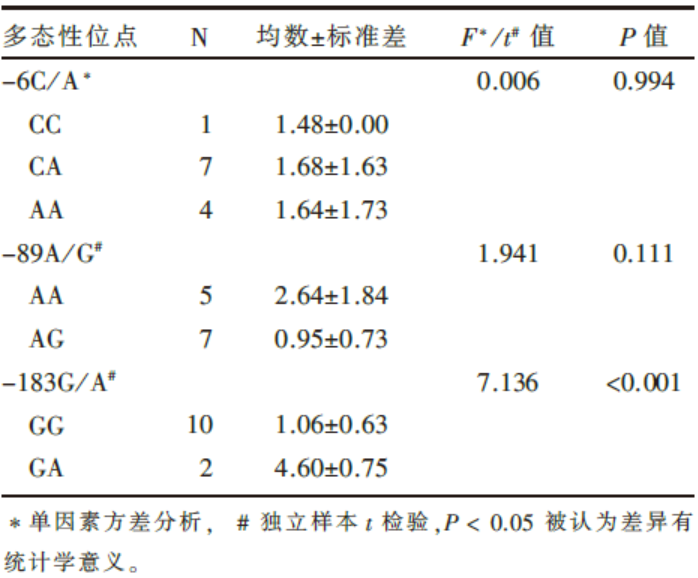
我们分析了不同细胞株中LN5启动子区的 -6C/A、-89A/G以及-183G/A等位点多态性与其mRNA表达水平的关系。-183G/A的GA基因型mRNA表达水平明显高于GG基因型(t=7.136, P< 0.001, 独立样本t检验)。本研究尚未发现-89A/G和-6C/A多态性位点基因型与mRNA表达水平的相关性, 见表3。
| 表3 肺癌细胞株中LN5多态性位点基因型与mRNA表达水平的关系 |
对在肿瘤的发生发展中起重要作用的基因单核苷酸多态性在人群中分布特征的研究分析是研究肺癌易感性和药物敏感性的有力工具, 对肺癌易感人群的筛检、肺癌的预防和治疗均具有重要意义。目前国内外对与肺癌有关的基因多态性的研究很多, 多集中在癌基因、代谢相关基因和DNA修复基因方面, 如P53基因、CYP2A6基因和ERCC1基因等[7, 8, 9]。对于在肿瘤侵袭和转移中具有重要作用的LN5基因的多态性与肺癌关系的研究尚未见报道。
本研究表明LN5启动子区-183G/A多态性位点与LN5基因mRNA表达水平相关。增强子(enhancer)是一段DNA序列, 其中含有多个能被反式作用因子识别与结合的顺式作用元件。反式作用因子与这些元件结合后能够调控(通常为增强)临近基因的转录。增强子一般位于转录起始点上游-100~-300 bp处[10]。因此推测-183G/A位点可能位于LN5基因增强子内, 属于功能性多态性, 可能与其调控转录有关而导致转录水平变化。我们在含激酶插入区受体(KDR)基因的研究中也发现[11], 位于基因5′ -UTR区的多态性(SNP)与基因的转录调控作用相关。
除启动子以外, 在几乎所有基因的上游区域中都还存在着激活基因所需的一段特定的DNA序列(转录因子结合位点, transcription factor binding site, TFBS)。这些序列本身并不执行任何功能, 只有当其被调控蛋白(转录因子)识别、结合后才能发挥作用, 它们共同控制着基因的转录。转录因子即反式作用因子在转录调控中可以直接或间接识别或结合在顺式作用元件8~112 bp核心序列上, 参与调控靶基因的转录效率。转录因子与其结合位点的结合具有高度的专一性。因此, 启动子序列或者转录因子结合位点任何一个碱基的变化, 都可能影响基因的表达水平。研究表明5′ -UTR区的碱基变化可通过影响启动子活性而调节转录活性[12]。不同的基因型可能导致个体之间转录和表达的差异。因此, 靶基因中特定转录因子结合位点的序列变化直接关系到转录因子是否可以结合以及结合的特异性, 有时候即使此序列中心区域一个碱基的变化就可能导致转录因子结合区域的消失, 从而影响基因的转录和翻译, 进而影响相关的一系列生物学变化。
本研究结果亦表明LN5基因mRNA表达水平与细胞株的病理类型相关, 但由于细胞株的样本量较小, 此结果尚需进一步研究。在人群中的研究表明, LN5经常表达在一些肿瘤的侵袭前线, 包括结直肠癌、胃癌、胰腺癌、乳腺癌、子宫颈癌和口腔鳞癌, 恶性黑色素瘤以及较小的肺腺癌(最大直径2 cm或以下), LN5 γ 2链高表达与患者的不良预后相关[13, 14, 15, 16]。在肝细胞癌的体外研究中表明, LN5通过Akt而降低了吉非替尼(抗表皮生长因子受体的小分子拮抗剂)的细胞生长抑制作用[17]。另一项在研究血管内皮生长因子受体抑制剂ZD6474的作用中发现, LN5可反转ZD6474引起的抑制肝癌细胞的增殖作用[18]。本课题组的一项研究也发现, 晚期肺癌患者应用吉非替尼治疗的疾病控制率与LN5 γ 2链mRNA表达水平相关[19]。由于LN5在肿瘤进展以及药物治疗中可能发挥着重要作用, 因此对其在肺癌中的较为全面和彻底的研究包括基因多态性的研究不仅对阐明肺癌的发生发展机制有重要意义, 也可能为肺癌的个体化治疗提供有益的启示
综上所述, 本研究提示LN5启动子区-183G/A多态性位点与LN5基因转录调控相关, 其转录调控的机制尚需进一步探讨。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|