| 黄慧强教授, 1984年中山医科大学医学系毕业, 1990年和1998年分别获得硕士和博士学位, 现任中山大学附属肿瘤医院内科副主任, 教授、主任医师, 博士生导师。中国抗癌协会淋巴瘤专业委员会常委, 中国临床肿瘤协会( CSCO ) 学术委员会委员, 广东省抗癌协会淋巴瘤专业委员会副主任委员, 广东省抗癌协会血液肿瘤专业委员会副主任委员, 美国血液学会(ASH)会员, 《癌症》、《中山大学学报》等多家杂志编委, 2000年和2004年曾到美国Fred Huchinsen Cancer Research Center和澳洲作短期进修, 擅长常见恶性肿瘤化疗, 特别是恶性淋巴瘤、鼻咽癌的化学治疗和造血干细胞移植, AHSCT治疗淋巴瘤和儿童肿瘤的数量在国内名列前茅, 近年来分别承担和参与了多项国家科委、省自然科学基金、省卫生厅基金等研究。参与多项国内、国际多中心随机对照临床研究, 主持和参与国家食品药品监督管理局多种新抗癌药物的研究, 国内外共发表论文90余篇, 主编和参编医学专著6部, 先后培养多名硕士和博士研究生。 |
Yoo C, Lee DH, Kim JE, et al. Limited role of interim PET/CT in patients with diffuse large B-cell lymphoma treated with R-CHOP[J]. Ann Hematol, 2011, 90(7):797-802.
2b。
对于接受R-CHOP方案治疗的初治弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)病例, 中期PET/CT(interim PET/CT, I-PET/CT)疗效评价是否能预测长期生存, 从而在治疗初期区分出疗效差的病例, 目前尚不明确。
在采用R-CHOP方案一线治疗的DLBCL病例中, 中期PET/CT疗效评价能否预测远期疗效。
• 研究条件: 韩国Ulsan大学医学院, Asan医学中心。
• 研究起止时间:2004年3月至2009年4月。
• 研究方法:单中心回顾性临床研究。
• 研究对象:接受R-CHOP方案一线治疗, 同时行中期或治疗后PET/CT检查的DLBCL病例。
• 评价指标:分早期代谢完全缓解(metabolic complete remission, mCR)(中期评价已CR)、延迟mCR(治疗结束后才取得mCR)和从未mCR三个亚组, 通过PET/CT评价亚组间的总生存率(overall survival, OS)和无进展生存率(progression-free survival, PFS)。
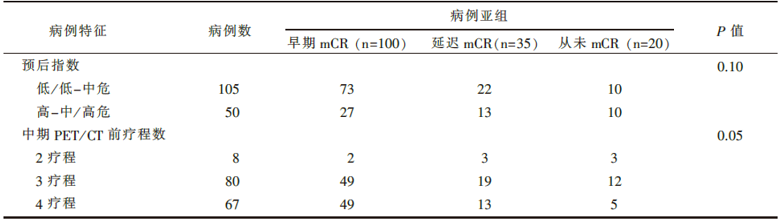
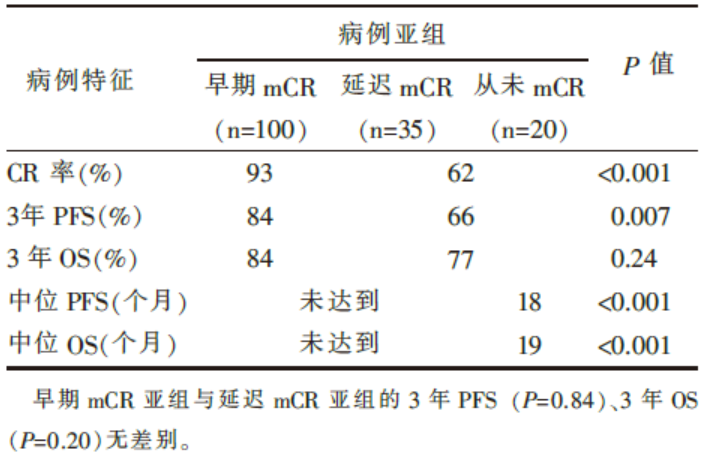
共155例病例入组, 中位随访期20个月(4~73个月), 入组病例的特征见表1, PET/CT疗效评价与长期生存的关系见表2。
| 表1 入组病例特征 |
| 表2 PET/CT疗效评价与长期生存的关系 |
中期PET/CT疗效评估预测复发或进展的能力, 在本组病例的敏感度为52%、特异性为68%。
中期PET/CT疗效评价对以R-CHOP治疗的初治DLBCL病例的远期生存的预测功能欠佳。
18氟脱氧葡萄糖(fluorodeoxyglucose, FDG)PET/CT是一种集解剖和功能于一体的新的检查手段, 在恶性肿瘤中的诊治中广泛应用, 特别在淋巴瘤的治疗前分期、治疗中期评估与再分期、治疗结束后疗效评价、组织学转化、随访监测以及协助造血干细胞移植时机选择等方面均有广泛的应用和报道, 迄今, PET/CT在恶性淋巴瘤的总体临床应用价值优于其他恶性肿瘤, 是现阶段淋巴瘤诊治领域的重要进展。由于PET/CT临床应用的时间相对较短, 因此仍有许多的问题有待进一步明确, 例如I-PET/CT评估在R-CHOP一线治疗DLBCL中的价值的确定, I-PET/CT通常是指在化疗2~3周期后的PET/CT检查, 其预测霍奇金淋巴瘤远期生存的价值已被证实。但在DLBCL中, I-PET/CT的应用价值尚存争论。
在早期的多数研究中, 利妥昔单抗尚未常规应用, I-PET/CT阳性的患者预后较阴性的患者差, 其2年OS为40%~73% vs. 90%~100%, 2年PFS率为 4%~43% vs. 82%~93%[1, 2, 3]。而当DLBCL的治疗进入利妥昔单抗联合化疗时代时, 多项重要的回顾性研究的结论并非一致。因此, I-PET/CT的预后预测价值的讨论再次受到广泛的关注。
Yoo等回顾性研究了2004-2009年间接受3周R-CHOP方案化疗的155例初治DLBCL患者, 对比分析了I-PET/CT和治疗后PET/CT的变化, 并根据最终的疗效, 将患者分为3组:早期mCR (I-PET/CT阴性, n=100), 延迟mCR (I-PET/CT阳性, 治疗后PET/CT阴性, n=35)和从未mCR (I-PET/CT及治疗后PET/CT阳性, n=20)。结果提示:与I-PET/CT阳性的患者相比, 早期mCR组患者的CR率较高(93% vs. 62%, P< 0.001), 但两组PFS(P=0.07)与OS(P=0.24)并无差别。另外早期mCR组与延迟mCR组患者的OS(P=0.84)与PFS(P=0.20)也无差别。该研究的重要意义在于, 首次提出在当前DLBCL的R-CHOP标准治疗条件下I-PET/CT的预后价值有限的观点。该研究设计合理, 病例数相对较多(n=155), 结论具有一定的参考价值。同时, 作者提出I-PET/CT的预后价值有限的原因可能在于:利妥昔单抗有可能促进局部炎症反应, 且I-PET/CT与化疗的间隔时间较短, 最终导致I-PET/CT的假阳性率较高。假阳性的结果削弱了I-PET/CT的预后价值。除此之外, Moskowitz等[4, 5, 6]的研究结果也支持该结论。以上研究的结果很可能会影响DLBCL治疗中期及治疗后的评估模式, 以及DLBCL的分层治疗策略。另外值得一提的是, Casasnovas等报道, 与传统的阳性或阴性的PET/CT评价标准相比, 化疗后PET/CT最大标准摄取值减少量(SUVmax reduction)可能具有更好的预测价值[7]。
该研究的不足之处在于:这是一项回顾性研究, 入组人群分布和化疗周期及剂量强度可能出现偏倚; I-PET/CT的执行时间未统一, 化疗2周期、3周期、4周期后接受I-PET/CT的患者分别占5%、52%和43%, 不同的化疗疗程数可能影响标准摄取值; I-PET/CT与化疗的间隔时间并未统一(2~3周不等), 局部炎症反应程度可能不同, 进而导致假阳性结果的出现; PET/CT扫描结果并未重新独立分析, 不同医师的分析结果可能出现偏倚; 阳性I-PET/CT的部位亦未活检证实以减少假阳性结果。
总之, 在利妥昔单抗联合化疗成为标准治疗方案的时代, 治疗后中期PET/CT给DLBCL的疗效评估、预后评估及分层治疗带来了全新的挑战, 考虑到PET/CT昂贵的价格, 目前我们并不推荐治疗中期多次的PET/CT作为常规检查的一部分。另外临床医师在分析治疗中期PET/CT或治疗后PET/CT的结果时应谨慎, 仅凭阳性的PET/CT结果尚不足以区分患者的预后并改变治疗策略, 最客观的办法是在阳性部位行活检以证实肿瘤是否残留。目前, 我们亟需大样本的前瞻性临床研究来进一步明确恶性淋巴瘤化疗中期PET/CT的价值。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|