作者简介:吴佳(1989-),女,甘肃嘉峪关人,兰州大学第二临床医学院2007级临床医学专业本科生。
目的 系统评价肠内免疫营养用于胃癌患者术后营养支持的近期疗效。方法 计算机检索Cochrane图书馆(2011年)、PubMed、EMBASE、CBM、CNKI、VIP、万方 (截至2011年10月)。收集肠内免疫营养用于胃癌术后营养支持的随机对照试验,采用Cochrane系统评价的方法,由 2 名评价者独立评价并交叉核对纳入研究的质量,对同质研究采用RevMan5.0软件进行Meta分析。结果 共纳入17项随机对照试验,包括812例患者。Meta分析结果显示:在免疫功能方面CD3[加权均数差=5.81,95%可信区间(2.64,8.99)]、CD4[加权均数差=6.10,95%可信区间(4.39,7.81)]、IgG[加权均数差=1.33,95%可信区间(0.70,1.96)]、IgM [加权均数差=0.16,95%可信区间(0.06,0.26)]及胃癌患者术后体内白介素-2、白介素-6水平方面,肠内免疫营养与对照组差异均有统计学意义。结论 肠内免疫营养对胃癌患者术后免疫功能的改善有一定疗效且可控制胃癌患者术后的应激与炎性反应程度,提高患者术后近期疗效。但限于纳入研究在方法学方面的局限性,尚需要开展高质量的随机对照试验进一步验证其疗效。
Objective To evaluate the clinical efficacy and safty of postoperative enteral immunonutrition in patients undergoing surgery for gastric cancer.Methods We searched the electronic bibliographic databases, including the Cochrane Library, PubMed, EMBASE, CBM, CNKI, VIP database and Wanfang database to assemble the randomized controlled trials (RCTs) of postoperative enteral immunonutrition in patients undergoing surgery for gastric cancer. The deadline of the retrieval time was October 2011. Data were extracted and evaluated by two reviewers independently with a designed extraction form. The RevMan 5.0 software was used for meta-analysis on homogeneous studies.Results Seventeen RCTs involving 812 patients were included. The results of meta-analysis showed that there were significant differences in CD3[WMD=5.81,95%CI(2.64,8.99)],CD4[WMD=6.10,95%CI(4.39,7.81)], IgG[WMD=1.33,95%CI(0.70,1.96)], IgM [WMD=0.16,95%CI(0.06,0.26)] and IL-2, IL-6 levels between the two groups of patients.Conclusion Enteral immunonutrition is effective to improve immunity, reduce stress and inflammatory reaction for postgastrectomy patients as compared with the control group. Limited to the study, more higher-quality RCTs are required to evaluate the effects.
胃癌是我国最常见的恶性肿瘤之一, 不同地区的发病率不同, 我国属胃癌高发地区, 每年胃癌死亡约16万人, 约占全部恶性肿瘤死亡人数的23%, 位居首位[1]。目前, 胃癌的患病率仍日益上升, 严重影响着人们的生命健康。胃癌的最有效治疗方法即为手术, 然而大多数的胃癌患者因肿瘤影响, 营养素的有效摄入不够, 吸收不足, 葡萄糖、脂肪、蛋白质等营养素的消耗又明显增加, 多伴有不同程度的营养不良和免疫功能低下。行胃大部或全胃切除术后的患者由于手术创伤、禁食、感染等应激作用, 机体处于高分解代谢状态, 蛋白质分解代谢速度大于合成速度, 机体蛋白质丢失, 出现负氮平衡, 进一步加重了患者营养状态的恶化及免疫功能的破坏[2], 易引起切口愈合不良、感染增加、吻合口漏、肝肾功能障碍等并发症, 影响了术后康复及后期治疗的效果, 甚至危及生命。
肠内营养支持是促进胃癌患者康复的重要治疗措施之一。临床和实验证实, 对早期进行肠内营养支持可降低手术创伤所致的高代谢率, 减少肠源性感染的发生, 促进患者预后[3, 4, 5, 6, 7]。但是, 普通的肠内营养制剂尚不能有效地改善患者术后的机体免疫功能。近年来的研究表明, 谷氨酰胺、精氨酸、ω -3脂肪酸等免疫营养素不仅能防治营养缺乏, 而且能以特定方式刺激免疫细胞增强应答功能, 维持正常、适度的免疫反应, 调控细胞因子的产生和释放, 减轻有害或过度炎症反应, 维持肠屏障功能等[8]。国内目前虽有部分临床试验研究了肠内免疫营养对胃癌患者术后免疫功能恢复等近期疗效的影响, 但其效果仍存在争议, 且没有系统的研究对其疗效加以肯定。
因此, 有必要利用系统评价的方法对肠内免疫营养对胃癌术后治疗的近期疗效做一客观评价, 以期为临床使用提供科学依据。
1.1.1 研究类型
含谷氨酰胺、精氨酸、ω -3多不饱和脂肪酸的免疫增强型肠内营养制剂对胃癌患者胃切除术后影响的随机对照试验(randomized controlled trial, RCT), 无论是否采用盲法。
1.1.2 研究对象
行胃切除术的胃癌患者。排除明显心、肝、肾功能障碍患者, 代谢性及内分泌疾病、全身感染、免疫缺陷病患者, 排除有肿瘤远处转移、肠道功能衰竭不能耐受肠内营养者, 排除近期使用糖皮质激素、人体白蛋白、免疫制剂及放化疗者。
1.1.3 干预措施
肠内免疫营养vs. 常规肠内营养。
1.1.4 测量指标
主要测量指标:与免疫功能相关的淋巴细胞总数、T细胞亚群、免疫球蛋白IgG和IgM。次要测量指标为白介素-2(Interleukin-2, IL-2)、白介素-6(Interleukin-6, IL-6)、术后感染发生率、C-反应蛋白。
计算机检索Cochrane图书馆(2011年第4期), PubMed(1966年至2011年10月), EMBASE(1974年至2011年10月), 中国期刊全文数据库(CNKI, 1994年至2011年10月), 万方数据库(1982年至2011年10月), 中国生物医学文献数据库(CBM, 1978年至2011年10月)和中文科技期刊全文数据库(VIP, 1989年至2011年10月)。检索词包括enteral immune nutrition、enteral immunonutrition、immunoenhanced enteral nutrition、 immunoenhanced enteral nutrition、 immune-enhancing enteral nutrition、gastric carcinoma、 gastric cancer、 stomach cancer、stomach carcinoma、 stomach neoplasms、 randomized controlled、胃癌、免疫肠内营养、肠内免疫营养、免疫增强型肠内营养、随机等。所有检索采用主题词与自由词相结合的方式。
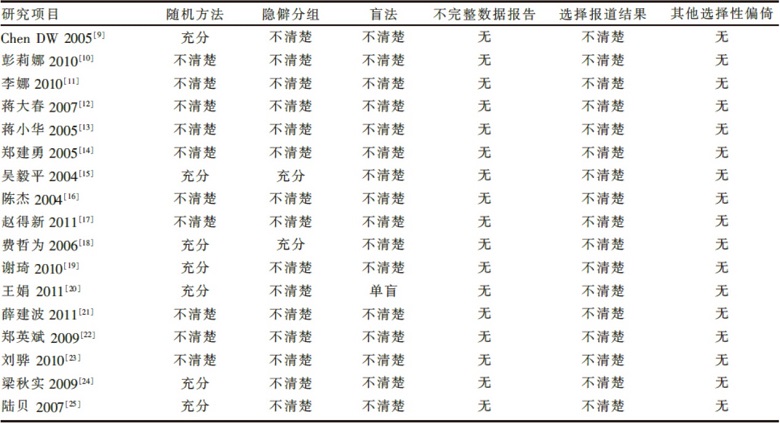
由两位研究者独立按照事先设计好的资料提取表, 提取以下信息, 包括:①试验的基本情况、两组患者的基线情况; ②干预措施、结局指标、失访及其处理; ③方法学质量。如临床试验文献的资料不全, 尽可能与原作者联系获取。遇不同意见由第三方仲裁。纳入文献的方法学质量分析依据Cochrane 评价手册5.0.1随机对照试验质量的6 条质量评价标准进行: (1)随机序列的产生方法; (2)隐僻分组方法; (3)盲法; (4)不完整数据报告; (5)选择报道结果; (6)其他选择性偏倚。
采用 Cochrane协作网提供的 RevMan5.0软件进行Meta分析。计数资料采用相对危险度(risk ratio, RR)为疗效分析统计量, 计量资料采用加权均数差(weighted mean difference, WMD)为疗效分析统计量, 各效应量均以95%可信区间 (confidence interval, CI)表示。各纳入研究结果间的异质性采用χ 2检验。当各研究间有统计学同质性(P> 0.1, I2< 50%)时, 采用固定效应模型, 反之, 采用随机效应模型。
初检文献418篇, 其中, PubMed 73篇, EMBASE 26篇, Cochrane 图书馆12篇, CNKI 229篇, VIP 21篇, CBM 14篇, 万方43篇。阅读题目及摘要后, 排除明显不符合纳入标准的文献, 进一步仔细查阅全文排除非随机对照试验, 最终纳入17个RCT, 包括812例患者。纳入研究的基本情况见表1。
| 表1 纳入研究的基本情况 |
所有17个研究均报道采用“ 随机分组” , 1项研究通过软件制作随机码将患者按入选的顺序随机分为两组[15], 1项研究采用信封法随机分组[18], 5项研究按随机数字表法分组[9, 19, 20, 24, 25], 其余研究均未报告具体的随机方法[10, 11, 12, 13, 14, 16, 17, 21, 22, 23]。此外, 15项研究均未报告是否采用隐蔽分组[9, 10, 11, 12, 13, 14, 16, 17, 19, 20, 21, 22, 23, 24, 25], 1项研究报告采用单盲[18], 详见表2。
| 表2 纳入研究的方法学质量 |
2.3.1 免疫功能
2.3.1.1 淋巴细胞总数
1项研究报告了淋巴细胞总数所占比例[10], 两组间差异有统计学意义(P=0.02)。
2.3.1.2 T细胞亚群
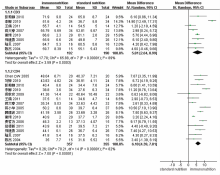
8项研究报告了肠内免疫营养对胃癌患者术后CD3细胞比例的影响[10, 11, 12, 14, 16, 19, 20, 25], Meta分析结果显示, WMD=5.81, 95%CI(2.64, 8.99), 两组间差异有统计学意义; 15项研究报告了肠内免疫营养对胃癌患者术后CD4细胞比例的影响[9, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 23, 24, 25], Meta分析结果显示, WMD=6.10, 95%CI(4.39, 7.81), 差异有统计学意义(图1)。
2.3.1.3 免疫球蛋白IgG和IgM
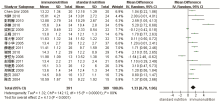
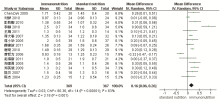
16项研究报告了肠内免疫营养对胃癌患者术后IgG的影响[9, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25], 各研究间有统计学异质性(P< 0.000 01, I2=89%), 采用随机效应模型进行Meta分析, 结果显示, WMD=1.33, 95%CI(0.70, 1.96), 两组间差异有统计学意义(图2); 15项研究报告了肠内免疫营养对胃癌患者术后IgM的影响[9, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 22, 23, 25], 各研究间有统计学异质性(P< 0.000 01, I2=83%), 采用随机效应模型进行Meta分析, 结果显示, WMD=0.16, 95%CI(0.06, 0.26), 两组间差异有统计学意义(图3)。
2.3.2 细胞因子
2.3.2.1 白介素-2
5项研究报告了肠内免疫营养对胃癌患者术后IL-2的影响[9, 12, 13, 14, 15], 各研究间无统计学异质性(P=0.39, I2=1%), 采用固定效应模型进行Meta分析, 结果显示两组间差异有统计学意义[WMD=27.97, 95%CI(4.57, 51.37)](图4)。
2.3.2.2 白介素-6
4项研究报告了肠内免疫营养对胃癌患者术后IL-6的影响[9, 12, 13, 17], 各研究间无统计学异质性(P=0.55, I2=0%), 采用固定效应模型进行Meta分析, 结果显示两组间差异有统计学意义[WMD= -83.77, 95%CI(-116.71, -50.84)](图5)。
2.3.3 术后感染发生率
6项研究报告了胃癌术后肠内免疫营养后的感染发生率[12, 16, 17, 19, 21, 23], 各研究间无统计学异质性(P=0.76, I2=0%), 采用固定效应模型进行Meta分析, 结果显示两组差异有统计学意义[WMD=0.50, 95%CI(0.28, 0.92)](图6)。
2.3.4 C-反应蛋白17个研究均未报告肠内免疫营养对胃癌患者术后C反应蛋白水平的影响[9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25]。
肠内免疫营养中添加的特殊营养素主要有精氨酸、谷氨酰胺、ω -3脂肪酸、核苷酸等。精氨酸作为一氧化氮合成的唯一底物, 通过一氧化氮的免疫调控机制刺激T淋巴细胞的增殖, 产生以提高T淋巴细胞间接反应为中介的免疫防御与免疫调节的作用; 谷氨酰胺除了可以修复肠上皮、维持肠屏障功能、减少肠源性感染外, 还能提高包括细胞因子合成和分泌、抗原提呈、吞噬等巨噬细胞的免疫功能; ω -3脂肪酸能以竞争的方式抑制花生四烯酸的代谢, 改变代谢产物的类型, 进而减轻机体的炎症反应, 保护免疫系统不受损害[8]。
本研究采用Meta分析的方法, 对含有谷氨酰胺、精氨酸、ω -3多不饱和脂肪酸的免疫增强型肠内营养制剂用于胃癌患者术后的有效性进行定量分析。结果显示:在免疫功能方面, 胃癌术后应用肠内免疫营养的患者体内T淋巴细胞总数、CD3、CD4、IgG、IgM水平明显高于对照组, 提示肠内免疫营养相对于普通肠内营养在一定程度可以更好地增强患者术后的细胞免疫和体液免疫功能。细胞因子水平方面, 免疫营养组IL-2水平高于普通肠内营养、IL-6水平显著低于对照, 差异均有统计学意义。IL-2是调控T细胞免疫的中心环节, 其分泌的增加可刺激T淋巴细胞大量增殖、分化, 以提高机体细胞免疫功能, IL-6是创伤、感染等应激状态下最重要的炎性介质, 其水平的下降可减轻应激反应程度, 有利于机体向合成代谢增加的方向发展, 说明免疫增强型肠内营养可控制创伤后患者的应激与炎性反应程度。6项研究报告了术后并发症[12, 16, 17, 19, 21, 23], 术后感染发生率两组间差异有统计学意义, 1项研究报告了免疫营养组腹泻、腹痛、恶心呕吐2例, 普通营养组4例[16]。没有研究报道C-反应蛋白水平。2项研究报告了患者术后住院时间[11, 21], 两组间差异无统计学意义[WMD=-1.56, 95%CI (-4.49, 1.36)]。说明胃癌术后肠内免疫营养可增强胃癌患者术后的细胞免疫及体液免疫, 控制术后患者的应激与炎性反应程度, 促进患者术后康复。
本研究纳入的17个RCT中, 5项研究按随机数字表法分组[9, 19, 20, 25], 1项研究采用信封法随机分组[18], 1项研究通过软件制作随机码, 按患者入选的顺序随机分组[15], 其余研究均未报告具体的随机方法及是否实施隐蔽分组[10, 11, 12, 13, 14, 16, 17, 21, 22, 23], 因此, 不排除其存在一定选择性偏倚的可能。仅1项研究报告采用单盲[18], 其余研究均未报道盲法的使用, 不排除存在实施和测量偏倚的可能性。各研究肠内营养开始时间不同, 5项研究肠内营养开始时间为术后第一天[11, 14, 15, 19, , 25], 10项研究为术后第二天[9, 12, 13, 17, 18, 20, 21, 22, 23, 24], 2项研究为术后第三天[10, 16]; 各研究肠内营养途径不同, 3项研究通过鼻空肠管或空肠造口管途径[9, 12, 13], 7项研究通过鼻肠管途径[18, 19, 20, 21, 22, 23, 24], 4项研究通过空肠造口管途径[10, 15, 16, 25], 3项研究肠内营养途径不明[11, 14, 17], 造成各研究间存在一定的异质性, 可能对合并研究结果产生一定的影响。
所有纳入研究均未报道例如患者生存期这样的远期和终点指标。因此, 建议在以后的研究中能进行长期随访, 重点评价胃癌患者长期的生存期及生存质量的改善, 根据各个要素的权重进行综合评价。国内外尚没有相关研究证实胃癌术后患者使用何种类型肠内免疫营养剂更好, 建议针对不同的肠内免疫营养剂对胃癌术后患者疗效影响的比较方面进行研究。
综上所述, 肠内免疫营养对胃癌患者术后免疫功能的改善有一定疗效且可控制胃癌术后患者的应激与炎性反应程度, 提高患者术后近期疗效。但缺乏对癌症患者的生存率等长期随访结果的观察, 加之限于纳入研究在方法学方面的局限性, 尚需要开展高质量的RCT进一步验证其疗效。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|