作者简介:吴一龙(1956-),男,广东汕头人,教授,博士研究生导师,主要研究方向为肺癌的多学科综合治疗及临床循证医学理论。E-mail: syylwu@live.cn
RECIST的全称是Response Evaluation Criteria in Solid Tumors,中文称为实体瘤疗效评价标准。在目前的癌症治疗中,不管是临床试验还是临床实践,在实体瘤的疗效评价中,RECIST扮演着无可代替的作用。但是,随着肿瘤分子生物学的进展,基于特定基因改变的分子靶向治疗,将传统化疗细胞毒药物对癌细胞的杀灭变为靶向癌细胞信号系统的细胞稳定,这就给药物的疗效评价带来新的挑战。本文将回顾抗肿瘤药物疗效评价的历史、目前的争论和未来可能的发展方向。
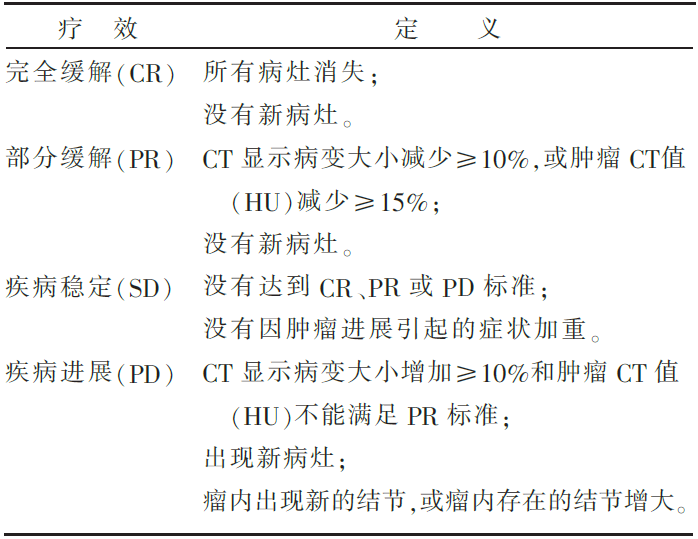
对实体肿瘤的疗效评价,最先起源于世界卫生组织(World Health Organization,WHO)的行动。1979年,WHO制定了基于影像学变化的实体肿瘤疗效评价标准,首次提出了疗效判定的四个等级:完全缓解(complete response, CR),部分缓解(partial response,PR),疾病稳定(stable disease,SD),疾病进展(progressive disease,PD)[1]。当然,最先的标准肯定是最不完善的,于是,2000年由欧洲肿瘤研究和治疗组织(the European Organization for Research and Treatment in Oncology)、美国国立癌症研究所(the National Cancer Institute of the United States)和加拿大国立癌症研究所(the National Cancer Institute of Canada)联手对WHO标准进行修订,保留了疗效的四个等级和影像学评价的原则,细化了各个标准的含义,从而推出了RECIST 1.0标准,2009年修订为大家目前使用的RECIST 1.1版本[2-3]。无可否认,在以细胞毒化疗药物为主的时代,RECIST扮演着极为重要的角色,几乎是现代所有癌症临床试验的疗效判断标准,也是美国食品药品监督管理局(food and drug administration,FDA)用于药物临床研究中评价药物疗效的一个重要指标,甚至可以说是金科玉律,稍一违反,便是格杀勿论。试举一例,标准规定,如果肿瘤直径比原来增加超过20%,便判断为疾病进展,是研究药物无效或失效的标准。
随着时代的进步,恶性肿瘤的治疗也在不断地进步,尤其是治疗手段的不断推陈出新,让人眼花缭乱,这当然也影响到肿瘤疗效评价的问题。其中重要的是,过去对晚期肿瘤的疗效评判标准,是建立在单一的细胞毒药物对肿瘤细胞杀灭基础上的,肿瘤的体积和生存预后紧密相关,因此,肿瘤的大小就显得极为重要。但今天的靶向药物,多数的作用体现在干扰癌细胞的信号通路从而抑制肿瘤细胞的生长,肿瘤细胞是否死亡并非重要,对整个肿瘤而言,其表现可能就是一个肿瘤大小的稳定、无变化。这样,依据影像学测量大小的疗效评判方法,对这种稳定肿瘤细胞为主的药物,就显得力有不逮了。临床观察发现,许多靶向药物作用于肿瘤细胞后,影像学上表现为坏死、密度变淡而没有肿瘤大小的变化,而抗血管生成的药物,影像学上又可表现为肿瘤的空洞化,肿瘤直径也没有改变,这些情况往往导致对疗效评价的低估。另外,有些极端的表现譬如肿瘤内出血,其影像学甚至表现为肿瘤体积的增大,用RECIST评价,可能误为疾病进展。
美国MD Anderson的影像学专家Choi等分别用CT或PET/CT作为影像学评价疗效的工具,研究了用RECIST评价靶向药物治疗胃肠间质瘤的疗效一致性,提出了靶向药物治疗胃肠间质瘤的CHOI疗效判断标准,见表1[4]。
| 表1 CHOI 疗效判断标准 |
CHOI标准目前在靶向药物特别是有关胃肠间质瘤的研究中有越来越多应用的趋向,但尚未得到官方的确认,因此其推广受到较大的限制。
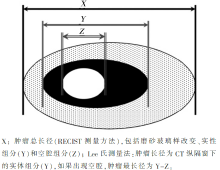
Lee等则针对抗血管生成治疗后出现的肿瘤内空腔现象,提出了修改的RECIST测量方法,见 图1[ 5]。
2010年,美国的Smith等根据肿瘤的大小和门静脉期CT增强图像上HU值的变化,提出了肾透明细胞癌多靶点药物疗效评价的SACT(size and attenuation on contrast-enhanced CT)标准,之后进一步修改为MASS(morphology, attenuation, size, and structure)标准。该标准一改RECIST的疗效四分法,将疗效三分为有效(favorable response)、稳定(indeterminate response)和无效(unfavorable response),见 表2[ 6]。
| 表2MASS疗效三分法 |
尽管上述新标准的提出者都提到RECIST标准仍是目前的药物包括靶向药物疗效评价的金标准,无可否认的是,RECIST标准在分子靶向时代已凸现其不足,因此才有各种各样的修订标准出台,但每个肿瘤都来定义各自的疗效评价标准显然也是不适宜的。因而,需要结合目前影像学方面的进展,制定出适合绝大部分实体瘤的疗效评价标准。
在RECIST标准及随后的各种修订标准中,大部分没有涉及到患者的主观症状。但在CHOI标准中首次有了症状评价,SD的标准之一是症状没有恶化。目前大家公认,晚期肿瘤治疗的总体目标,为提高生存质量、延长患者寿命。生存质量的一个重要标准,就是症状的控制是否有效。由此带出来的一个问题是:如果是没有症状的晚期肿瘤,治疗的介入时机如何界定?要回答这一问题,必须回答靶向药物在有症状和无症状、肿瘤负荷大或小之间是否存在疗效或生存期的不同,但这一方面的数据、证据极为贫乏。2012年Yang等建立的非小细胞肺癌靶向药物耐药模型,将肺癌相关症状的变化列为模型判断标准之一[ 7]。他们将肺癌相关的5大症状咳嗽、血痰、胸痛、气促、发热和转移病变引起的相关症状量化为无症状、治疗前后症状稳定和原有症状恶化或出现新症状3个等级,只有症状变化的,才会影响到生存期,这提示症状的变化应考虑到新的疗效判断标准中,问题是,症状属于主观感觉,如何做到量化和可重复性是一大难点,将目前评价肿瘤患者生活质量的“患者自我报到系统”引入标准中,应是可行的方法,但仍需做许多工作才能最后确定其可行性。
分子靶向时代新靶向药物的出现,挑战了目前的RECIST疗效评价系统,如何将影像学包括增强CT、增强MRI或PET/CT功能影像学的发现和症状评分结合到新的疗效评价系统中以建立一个广适性的疗效评定标准,应是实现个体化肿瘤学的近期重要工作之一。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|