| 程颖,二级教授,博士研究生导师。卫生部有突出贡献的中青年专家,享受国务院特殊津贴。现任吉林省肿瘤医院院长、吉林省肿瘤防治研究所所长、吉林省肿瘤防治研究所办公室主任、吉林省肺癌诊疗中心主任,现还担任中国抗癌协会临床肿瘤学协作中心常委、中国抗癌协会常务理事、中国抗癌协会肺癌专业委员会常委、中国临床肿瘤学会小细胞肺癌专业委员会主任委员、中国抗癌协会化疗专业委员会常务委员、中华医学会肿瘤专科委员会委员、吉林省医学会肿瘤专业委员会主任委员等,担任多家杂志编委。从事肿瘤内科的基础和临床研究工作,在肺癌的规范化诊断、多学科综合治疗及分子靶向基础研究方面具有丰富的经验及深厚的学术造诣,大力推广规范化、个体化的肿瘤诊疗理念。先后撰写专业学术论著6部,发表学术论文百余篇,承担国家及省市科研课题多项。 |
Su KY, Chen HY, Li KC, et al. Pretreatment epidermal growth factor receptor(EGFR) T790M mutation predicts shorter EGFR tyrosine kinase inhibitor response duration in patients with non-small cell lung cancer[J]. J Clin Oncol, 2012, 30(4):433-440.
2a。
•大型随机对照临床研究证实,具有表皮生长因子受体(epidermal growth factor receptor,EGFR)活化突变的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者接受EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)治疗可获得显著疗效,但是最终都会出现耐药,约50% EGFR-TKI获得性耐药患者出现EGFR T790M突变。一些研究提示TKI治疗前肿瘤细胞内已存在低拷贝数的T790M,随着TKI药物选择性压力的作用而逐渐成为耐药的主要原因。
•临床上T790M的检测受到限制,T790M究竟是原发还是继发产生尚无定论。
•采用高灵敏度方法检测TKI治疗前低拷贝数的T790M状况与TKI临床疗效之间的关系仍不清楚。
•采用高灵敏度的检测方法检测EGFR T790M。
•评价高灵敏度方法检测出的EGFR T790M状态与EGFR-TKI临床疗效的相关性。
•研究条件:中国台湾台中荣民总医院,国立台湾大学医学院附设医院。
•研究起止时间:2000年3月至2008年1月。
•研究方法:多中心回顾性临床研究。
•研究对象:107例接受外科手术切除但未接受EGFR-TKI治疗的非小细胞肺癌患者的标本;88份接受EGFR-TKI治疗的Ⅲ~Ⅳ期非小细胞肺癌标本。
•干预措施:分别用测序法、基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)法、新一代测序(next-generation sequencing,NGS)法检测EGFR基因突变状态。同时在接受EGFR-TKI治疗的非小细胞肺癌中,分析采用MALDI-TOF MS方法检测出的T790M状态与TKI临床疗效之间的关系。
•评价指标:百分率,无进展生存期(progression-free survival,PFS)。
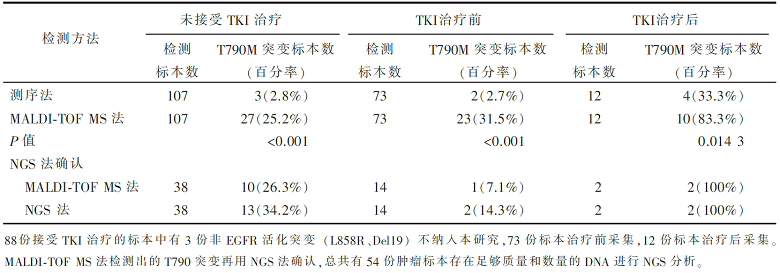
三种不同方法检测的EGFR T 790M 结果见 表 1。
| 表1 三种检测方法检测T790M |
为了比较高灵敏度MALDI-TOF MS法检测的结果与测序法或NGS法是否一致,用κ值进行相关性分析,MALDI-TOF MS法和NGS法检测的T790M突变结果之间的相关性具有统计学意义(κ=0.663, P<0.001),但MALDI-TOF MS法和测序法发现T790M突变结果之间的相关性无统计学意义(κ=0.176, P<0.140 5)。
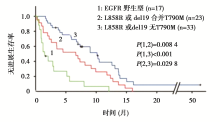
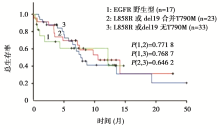
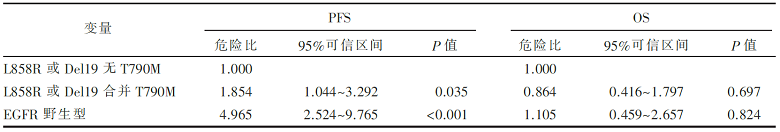
在73例接受TKI治疗前的标本中,MALDI-TOF MS法发现56例具有EGFR活化突变(L858R、Del19),其中23例合并有T790M突变,33例无T790M突变。各组的PFS和总生存期(overall survival,OS)结果见 图1、 图2和 表2。
| 表2 COX回归模型 |
非小细胞肺癌中T790M突变可能并不罕见。EGFR-TKI治疗前存在的T790M突变,与更短的PFS相关。
EGFR基因的20号外显子T790M突变被认为是NSCLC患者接受EGFR-TKI治疗后获得性耐药的主要原因之一。研究数据表明尽管有众多机制参与其中,但T790M突变约占TKI获得性耐药的50%[ 1]。既往研究结果显示,治疗前EGFR基因T790M突变是一个偶发事件,因此对于治疗前T790M突变的临床意义仍有争论。本文献采用高灵敏性的检测方法,即基质辅助激光解吸电离飞行时间质谱法(MALDI-TOF MS)对于治疗前和治疗后的NSCLC患者进行了检测,系统地分析了该方法的灵敏性、特异性及其与临床因素的相关性。研究结果显示T790M是NSCLC患者接受TKI治疗后PFS的独立预后不良因素。
本文献为回顾性研究,共选择了3个非小细胞肺癌患者群,在方法学上对比了直接测序法和MALDI-TOF MS法,并采用新一代测序技术(NGS)对检测结果进行验证。研究者认为MALDI-TOF MS法对比直接测序法,在检测EGFR基因T790M突变方面具有非常高的灵敏性。未接受过TKI治疗的患者中,T790M突变检出率分别为25.2%(MALDI-TOF MS法)和2.8%(直接测序法);TKI治疗前患者的检出率分别为31.5%(MALDI-TOF MS法)和2.7%(直接测序法);TKI治疗后患者的检出率分别为83.3%(MALDI-TOF MS法)和33.3%(直接测序法)。此外,本文献的亮点还在于采用MALDI-TOF MS法可以对T790M的突变量(突变丰度)进行分析,因此,该方法对于肿瘤组织较少的患者来说是一种好的选择,也为未来临床上根据T790M的突变量选择治疗方案提供了可能。
本文献的研究结果带给我们很多启示。采用MALDI-TOF MS法检测T790M显示NSCLC中de novo T790M突变可能并不是低概率事件,且突变阳性和阴性患者的PFS有差异,这说明基因突变的检测手段不同,直接影响对患者疗效和预后的评估。因此在临床应用中,应尽可能采用高灵敏度且标准化的检测方法,对患者进行深入的分层,才能制定更细致的个体化治疗方案。以往文献报道,采用MALDI-TOF MS法检测EGFR基因活性突变的敏感性为5%,在本文献中检测T790M的敏感性为0.4%~2.2%,提示我们,同一基因的不同突变类型(例如缺失、插入、置换等)是否需要采用不同的检测方法,以便达到更高的敏感性和特异性?本文献报道的T790M含量为0~31.1%不等,提示我们基因突变除了需要定性检测,是否还需要进行定量测定以确定突变的丰度问题,以及定量数据中如何界定cut-off值等。
本文献的研究结果带给我们更多思考。在既往文献报道中,检测T790M突变的方法包括基因扩增后直接测序法(DS)、突变富集PCR法、扩增阻碍突变系统(ARMS)法、蝎形探针扩增阻滞突变系统(scorpions ARMS)法、集落杂交法(CH)和NGS法等[ 2, 3]。在众多方法中,DS法的敏感性最低,NGS的敏感性和特异性最高。本文中,相对于DS来说,MALDI-TOF MS是一种高灵敏度的检测方法,但相对于NGS来说,MALDI-TOF MS法检测的敏感性仅为64.7%(11/17),特异性为95% (35/37)。仔细分析数据我们发现,在2例患者中发现直接测序法和 MALDI-TOF MS法检测结果不一致,似乎NGS的检测结果与直接测序法的结果更一致。因此还需要检测更多的临床标本来评估MALDI-TOF MS法的敏感性和特异性。本研究报道的所有T790M突变患者都伴有EGFR活性突变,虽然T790M的突变状态并不影响患者的OS和相对危险度,但同时存在EGFR基因L858R突变或19DEL及T790M突变患者的PFS劣于仅有L858R突变或19DEL患者,而优于无上述任何突变的患者,该结论与2011年发表的一项研究结论一致[ 4]。但ERUTAC检测了123例标本中T790M突变情况并进行了与生存的相关性分析,结果显示接受厄洛替尼治疗的64例患者中,T790M突变患者(21例)的中位OS长于无T790M突变患者(26.8个月 vs. 13.0个月)。美国Oxnard等[ 5] 学者的研究也显示T790M基因突变患者进展后生存期显著长于无突变患者(19个月vs. 12个月)。近来亦有研究报道de novo T790M突变的患者肿瘤进展缓慢、生存时间较长,因此T790M突变在预测病人预后方面所扮演的角色还有待考究。
由于该研究受回顾性研究所限,样本数相对较少且存在组间的不平衡性,因此还留下很多疑问。在本文献中,采用TKI治疗的EGFR野生型病人PFS最短,这与目前得到共识的EGFR野生型患者采用TKI治疗不能获益相一致。未来de novo T790M突变的患者该采用何种治疗措施,是单独使用EGFR-TKI、联合或序贯化疗、单独使用化疗?T790M突变量(丰度)差异是否与客观缓解率、PFS和OS相关?同一标本治疗前后T790M突变率变化如何?这些结果会对我们探讨T790M在耐药及预后中的作用更具有指导性意义。
未来我们需要更多的样本和多中心的检测来优化T790M的检测方法,开展更多的前瞻性研究以探讨T790M突变产生的原因以及评估T790M突变和突变量与耐药及预后之间的相关性,合理选择治疗方案。目前针对T790M突变的不可逆EGFR-TKI如Neratinib(HKI-272)、Afatinib(BIBW2992)、Dacomitinib(PF-0299804)等已经用于临床研究并具有较好的临床前景,如果我们能通过优化检测方法并进一步确定T790M导致耐药的“丰度”阈值,则对我们更加精确地选择治疗方案有重要意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|