| 马胜林,主任医师,教授,博士研究生导师。现任杭州市第一人民医院医疗集团院长,杭州市肿瘤医院院长,浙江省医学科学院肺癌研究所所长。中国抗癌协会放疗专业委员会副主任委员,中国抗癌协会抗癌药物专业委员会副主任委员,中国抗癌协会临床肿瘤学协作中心脑转移肿瘤专家委员会副主任委员,浙江省医学会放疗分会主任委员,浙江省抗癌协会药物专业委员会、放疗专业委员会主任委员。担任多家杂志编委及审稿人。致力于胸部恶性肿瘤的放化疗、热疗、生物治疗、中西医结合治疗、个体化治疗等非手术综合治疗的基础与临床研究。在国内外学术期刊上发表论文70余篇,主编专著4部。 |
Oxnard GR, Arcila ME, Sima CS, et al. Acquired resistance to EGFR tyrosine kinase inhibitors in EGFR-mutant lung cancer: Distinct natural history of patients with tumors harboring the T790M mutation[J]. Clin Cancer Res, 2011,17(6):1616-1622.
1b。
表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的肺腺癌患者,在10~16个月的中位时间后,会出现对EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)获得性耐药,而其中一半的患者是由于EGFR T790M再次突变。
研究接受TKI治疗的含T790M突变的肺腺癌患者的预后,与不含T790M突变的肺腺癌患者进行对比研究,明确其特点。
•美国纽约康奈尔大学Weill医学院,单中心、临床病例对照研究。
•研究时间:2004年8月选择合适患者进行研究,随访至出现死亡终点。
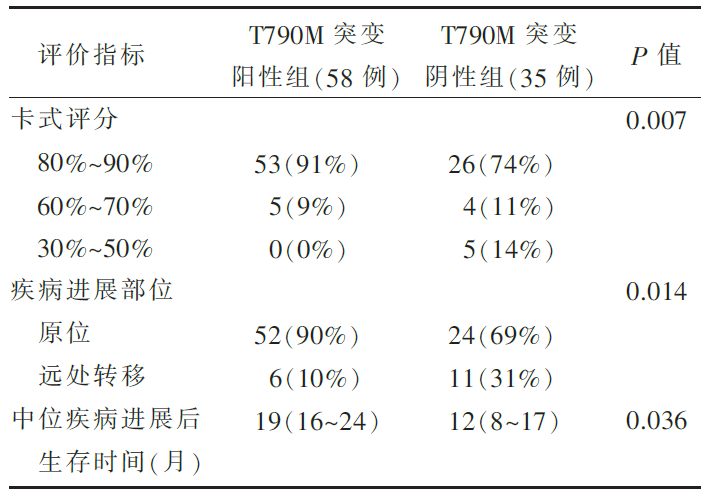
•研究对象:患者的入组条件为,曾对TKI治疗有临床获益,或者病情持续稳定(>6个月)。接受TKI联合化疗的患者,如果含EGFR突变也纳入研究。共93例患者进入研究,其中T790M突变阳性58例,T790M无突变35例。
•评价指标:中位疾病进展后生存时间、疾病进展部位、卡式评分。
•干预措施:继续使用或不使用TKI治疗。
•T790M突变在肺或胸膜、淋巴结活检结果中更常见( P=0.014)。
•入组患者总体疾病进展后的中位生存时间为16个月(四分位间距为9~29个月),其中含T790M突变的患者则更长( P=0.036)。
•不含T790M突变的患者更易侵犯当前未受累器官( P=0.014),且在疾病进展期的病情会更差( P=0.007),见 表1。
| 表1 两组患者的病情评价 |
在对EGFR-TKI获得性耐药的患者中,T790M突变这一类群体可有相对良好的预后以及相对缓慢的病情进展。
肺癌是全世界范围内肿瘤死亡的首要原因,每年全球约有140万人死于肺癌[ 1]。近年来,随着EGFR为靶点的TKI的应用,肺癌患者的治疗得以突破性进展,中位生存时间可延长至24个月。15%~30%的肺癌患者携带有EGFR敏感性突变位点,他们对EGFR-TKI的有效率接近70%[ 2]。然而遗憾的是,大部分患者在接受靶向治疗10~16个月后不可避免地出现获得性耐药[ 2, 3]。
获得性耐药的分子机制比较复杂,除了与MET基因扩增、小细胞肺癌转化、PIK3CA突变、AXL及其配体GAS6表达上调相关外[ 4, 5, 6, 7],研究最多的是EGFR T790M突变,在EGFR-TKI获得性耐药的组织标本中,其突变率可高达50%[ 8, 9, 10]。T790M突变是EGFR第790位氨基酸由苏氨酸转变为甲硫氨酸,分子模拟提示T790M改变了ATP的亲和性,从而导致EGFR-TKI不能有效阻断信号[ 11]。尽管EGFR T790M突变是EGFR-TKI获得性耐药的关键机制之一,但前期的体外研究却显示T790M耐药细胞株表现为生长缓慢[ 12]。
为了探讨EGFR T790M突变的预后意义,本文献Oxnard等检测了93例EGFR-TKI耐药患者重新活检标本中EGFR T790M的突变率。结果显示在所有重新活检的标本中,T790M突变率为62%。其中,肺/胸膜和淋巴结活检组织中T790M的突变率明显高于其在远处转移器官活检组织中的突变率( P=0.014);90%的T790M突变患者,疾病进展表现为原发灶复发,只有10%的患者出现新的转移灶,而无T790M突变的患者中却有31%的患者出现新的转移灶( P=0.014)。此外,携带T790M突变患者从进展到新的转移灶出现的中位时间明显长于无T790M突变患者(14个月vs. 4个月, P=0.008);携带T790M突变患者进展后的中位生存时间为19个月,明显长于无T790M突变患者12个月的中位生存时间( P=0.036)。然而,多因素分析并不支持T790M突变是独立的预后指标。这些结果提示EGFR T790M突变耐药有独特的生物学行为,相对于非T790M突变导致的耐药,患者的病理特征和预后更好。非T790M突变耐药的患者可能有更恶性的分子特征,同时介导着肿瘤细胞的远处转移。
EGFR-TKI耐药后治疗方案的选择极大地困扰着临床医师,因此区分T790M突变与否对临床可能有一定的指导意义。EGFR T790M突变的患者可能更加依赖EGFR信号轴的分子通路[ 13],提示进展后继续应用TKI患者仍会获益,而且有可能会对新的靶向EGFR及其信号通路的治疗策略更为有效。然而,重新获取活检组织标本检测耐药后EGFR的基因型对目前的临床实践有一定的挑战性,因此呼吁微创、标准化T790M突变检测技术的推广和应用。
该研究是目前最大的耐药后复发/转移肿瘤组织中EGFR T790M突变检测临床研究,设计合理,结论也比较有意义。但正如作者所述,研究仍存在一定的局限性。该研究的目标是进展后再次转移时间和进展后生存时间,然而,进展时间比较难定义,尤其是那些在治疗过程中缓慢进展的患者,这些可能产生一定的偏差。此外,患者在EGFR-TKI治疗前T790M突变的状况并不清楚。近期的文献报道T790M在EGFR-TKI治疗前也有低克隆的突变,它们在随后的治疗中被筛选和放大[ 14, 15],治疗前EGFR T790M突变的患者比无T790M突变的患者预后好[ 14, 16]。
总之,本研究结果表明T790M突变介导的EGFR-TKI耐药患者进展相对缓慢、预后较好,提示T790M突变有可能是一个重要的预后或耐药机制分子标志物,因此作者也建议在未来研究TKI获得性耐药的临床研究中应该常规检测T790M的突变状态。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|