|
周彩存,男,1962 年9 月生,医学博士,主任医师,教授,博 士研究生导师。现任同济大学医学院肿瘤研究所所长,肿瘤学 系主任,附属肺科医院肿瘤科和临床药理机构主任。中国抗癌 协会肺癌专业委员会常委,中国临床肿瘤学会(CSCO)执委会 委员,上海市抗癌协会理事,上海市肺科学会和肿瘤学会委员; 美国临床肿瘤学会(ASCO)和国际肺癌研究会(ISALC)会员。 《临床肿瘤学杂志》、《中国肺癌杂志》、《肿瘤》等杂志编委。曾在 日本留学二年,美国进修半年。在国内外期刊上发表学术论文 100 余篇。主要研究方向为肺癌综合个体化治疗和生物靶向治 疗等。目前主持国家863、自然科学基金和上海市科委重大攻 关等课题5 项。 |
Chen ZY, Zhong WZ, Zhang XC, et al. EGFR mutation heterogeneity and the mixed response to EGFR tyrosine kinase inhibitors of lung adenocarcinomas[J]. The Oncologist, 2012,17(7):978-985.
2c。
表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者对酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)的药物反应不一致。
对EGFR基因突变的肿瘤的异质性进行研究。
•研究条件:广东省肺癌研究所。
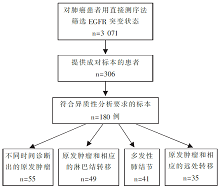
•研究对象:180例有成对肺腺癌标本的EGFR突变患者。
•干预措施:见 图1。
•评价指标:采用DNA直接测序法分析所有成对标本的激活的EGFR突变。如果原发灶和相应的转移灶发生相同的突变,认为其为均质性。如果其突变不同,再采用高分辨率溶解曲线法(HRM)验证以保证直接测序的准确性。
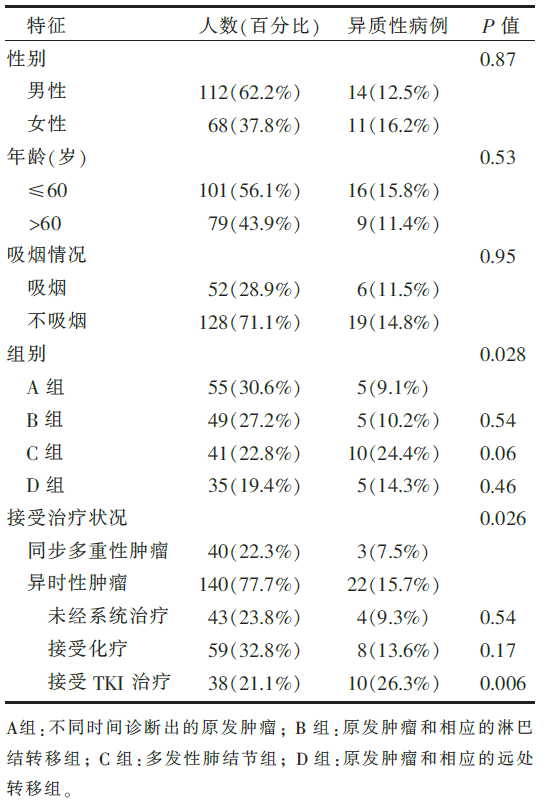
•180位参与试验患者的病理生理特征见 表1。
| 表1 患者的病理生理特征 |
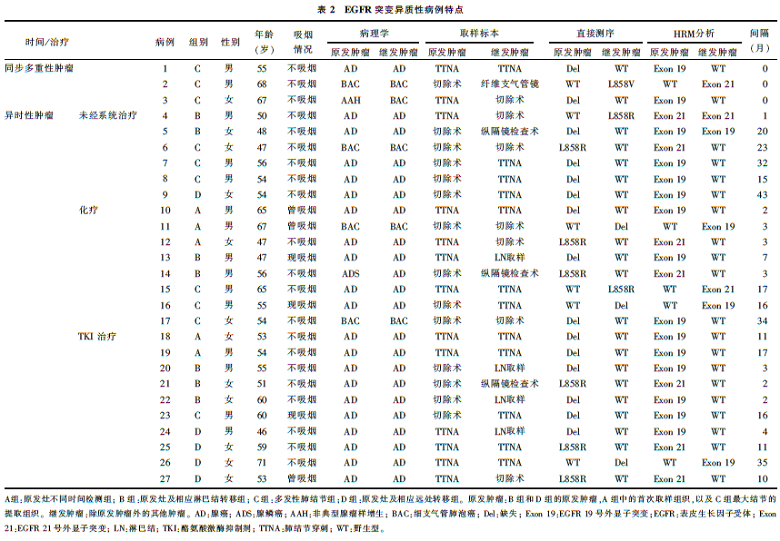
•共27例采用DNA直接测序表现出不一致性,25例采用HRM法进行了验证。试验病例的总体不一致率为13.9%(25/180),EGFR突变异质性病例的基本情况见 表2。
| 表2 EGFR突变异质性病例特点 |
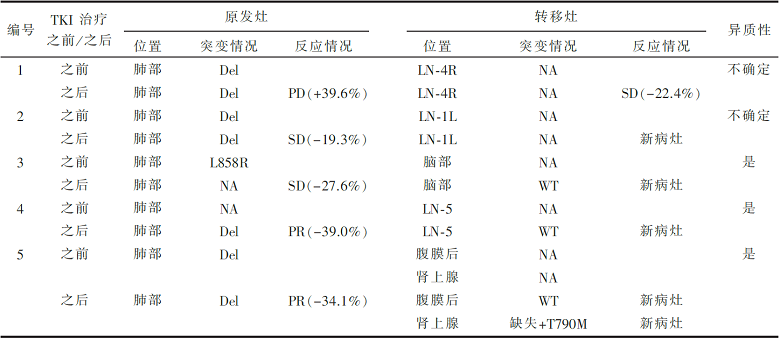
•原发肿瘤和相应转移灶、同步多重性和异时性肿瘤组的EGFR 突变变异性,见 表3。
| 表3 5例对TKI 治疗的不一致性反应 |
•多变量分析:在多发性肺结节患者和接受TKI治疗的患者中,异质性显著升高。
亚洲肺腺癌患者中存在EGFR突变异质性,但整体的不一致率相对较低。仅多发性肺结节患者的异质性比例明显较高,可对EGFR-TKI的肿瘤反应不一致性作出解释。
如果能统计一下 ClinicalTrials.gov 上登记的临床试验,我们肯定会发现靶向药物几乎占据了现在抗肿瘤药物研发项目的全部。这意味着,在未来的10年(或者更短的时间里),靶向药物必将成为非小细胞肺癌治疗选择的主流。但是,肿瘤似乎永远比人类要聪明,新的问题又随之而来。今年以来,多篇研究肿瘤基因组学异质性的重量级文献,似乎又将我们带入了一个完全未知的肿瘤领域。一时间,各种繁复研究争相发表,但作为临床医生,总觉其是蜻蜓点水,都仅局限于科研层面的机制探索。
本文献以其精巧却又不失严密的逻辑设计和严谨详实的研究结果,从科研与临床两个方面,不但确证了肺癌EGFR突变存在异质性,而且对肿瘤异质性的临床意义也做了深入探讨,更难能可贵的是,该研究为将来肿瘤异质性,甚至是驱动基因理论的深入研究提供了宝贵的线索。
众所周知,肺癌的肿瘤异质性的问题由来已久。最典型的实例便是腺鳞混合癌和复合型小细胞癌。此外,如果按JTO(Journal of Thoracic Oncology)上发表的最新肺腺癌分型来定义[ 1],即便是我们之前认为的单纯腺癌,其中93%也为具有不同预后意义的腺癌亚型的混合肿瘤。可见,病理学亚型上的肿瘤异质性这一老问题可谓十分普遍。
2008年,已有部分学者发现肺癌基因组学层面也存在异质性。但是,直到近年来,随着全基因组测序技术的突破,才真正揭开了肿瘤基因组学的面纱。基于该技术,2012年发表在新英格兰医学杂志的肾癌异质性研究首次证实了肿瘤基因异质性的存在[ 2]。之后,Nature、Science、Lancet Oncology接连发表评论文章,探讨肿瘤基因异质性的机制及其重要意义。
显然,肿瘤异质性的故事尚未结束。2012年底,在Science杂志发表的一篇重磅级论文中[ 3],研究者采用单个癌细胞建立移植瘤模型进行传代培养。结果发现,在后代肿瘤细胞均具有相同基因组学变异的前提下,肿瘤细胞的功能却发生了明显变化。无论是肿瘤细胞的增殖能力还是对奥沙利铂的敏感性,均表现出惊人的不一致。由此,作者提出了肿瘤细胞还存在功能异质性的结论。
但是,上述研究仅在机制上证实了肿瘤异质性的存在。作为临床医师,我们不禁要问,肿瘤异质性对我们临床诊疗和转化性研究会带来何种影响,我想该研究的意义便在于此。
虽然已有研究证实了EGFR基因突变在非小细胞肺癌中存在异质性。但是,这些研究大多停留在实验室中对多点活检的肿瘤组织进行基因检测的基础上。与其不同的是,由于巧妙地将肿瘤标本按照时间和空间上的不同分为4个组别,该研究首次从两个临床因素层面提示肿瘤异质性的存在,对我们的临床实践具有非常重要的指导意义。
首先,该研究的主要发现之一——多发肺部结节患者的肿瘤异质性发生率最高(26.3%,10/38)。先让我们把肿瘤想象成具有不同特征的人组成的人群,如果混在一起,我们很难对不同的人群进行区分,但是如果把这群人单个区分开来的话(单克隆肿瘤细胞的转移),其中的差异(异质性)便一目了然。因此,该研究中原发肿瘤和转移灶配对组(14.3%,5/35)、原发肿瘤与淋巴结转移配对组(10.2%,5/49)与异时性原发肿瘤组(9.1%,5/55)的异质性发生率依次降低,更是从临床层面印证了肿瘤异质性的存在。
其次,该研究的第二个发现——TKI治疗组患者(而不是化疗组或未接受治疗组)的肿瘤异质性发生率明显升高(比值比8.70, P=0.006)。由于肿瘤异质性的存在,在肿瘤内部同时可能存在EGFR突变型克隆和EGFR野生型克隆。如果EGFR-TKI将突变型克隆的癌细胞杀死,那么剩下能够增殖的便是以EGFR野生型为主的癌细胞,从而表现出原发诊断时没有发现的肿瘤异质性。
虽然上述两个发现均是证明肿瘤异质性存在的必要条件而非充分条件。但是,该研究首次提示了肿瘤异质性对我们临床诊疗的影响。由于TKI治疗后混合疗效的存在,为评价化疗药物疗效而建立的RECIST标准似乎已经不能完全适用于靶向药物。对现有肿瘤评价标准产生质疑,也是该研究的重要临床意义。
我们都知道,同为驱动基因变异的EGFR 19号外显子的缺失和21号外显子的L858R突变通常存在相互排斥。在该研究的肿瘤异质性中,都是上述一种变异与野生型共存,即便是在异时性的肿瘤中,也未发现上述两种变异的共存。基于肿瘤驱动基因理论,每一个癌细胞均应存在对驱动其恶性生长起主导作用的基因变异。因此,在这部分EGFR野生型的癌细胞中是否存在其他我们未知(或者说未探索过)的肿瘤驱动基因的变异呢?如果存在,在这些同一肿瘤中,除EGFR突变以外的基因变异又是什么呢?如果我们能有所发现,那么EGFR-TKI联合另一个(或者多个)靶向药物同时治疗的话,我们是否就能够在最大程度上杀死肿瘤呢(单用EGFR-TKI很少能达到完全缓解)?由于全基因组高通量测序技术的不断完善,解决上述难题似乎只是个时间问题。
两个重要发现,一条宝贵线索,不得不说该研究试验设计的合理性和分析结论的逻辑性非常值得我们临床医师学习。希望每位医师都不错过这篇必将影响我们将来靶向药物治疗策略的重要文献。
| [1] |
|
| [2] |
|
| [3] |
|