患者女性,52岁,因“体检发现肝占位1周”收治。患者于入院前1周因高血压在深圳市孙逸仙心血管医院住院时行彩超发现肝脏右前叶上段实质性占位病变,性质待查,未行特殊处理。入我院行进一步诊治。
辅助检查:
2010-03-03深圳市孙逸仙心血管医院心脏彩超见:左心室左心房肥大,左心室舒张功能下降;腹部B超见肝右叶占位,胆囊息肉。
2010-03-10我院B超、MRI见肝S5、S8处10 mm×10 mm、 35 mm×35 mm 大小病灶,考虑多发占位病变,恶性可能性大。肠镜提示:距肛门13 cm肿物,活检病理结果提示直肠腺癌。
2010-03-16我院PET/CT结果提示:直肠癌并肝多发转移。
2010-03-18我院CEA(发光法)301.81 ng/mL; CA19-9(电发光法)183 U/mL。
入院诊断:直肠癌并肝转移,Ⅳa 期。
李勇(胃肠肿瘤外科副主任医师):病情介绍(略)。提出讨论要点问题:该患者下一步的治疗策略?
林锋(胃肠肿瘤外科主任医师):该患者临床分期为Ⅳa期,面对这个结直肠癌合并单一器官远处转移的病例,由于这个肝脏转移灶属于可切除病灶,目前我们可以采取术前新辅助化疗、同期或分期手术切除原发病灶和肝转移灶。在这个病例中,我们不考虑术前新辅助放化疗,因为原发直肠肿瘤距离肛门13 cm,属于直肠上段肿瘤,位于腹膜反折以上,其生物学特性与结肠相似,而新辅助放化疗是针对低位直肠癌的。这一点在NCCN 2011年直肠癌临床实践指南(中国版)中已经有所体现,放疗仅推荐用于距肛缘12 cm以下的直肠肿瘤。
旁述:结直肠癌肝脏转移可分为三类:可切除的肝转移,潜在可切除的肝转移,不可切除的肝转移。关于结直肠癌肝转移的外科切除标准或手术根治标准,一直在发展变化,目前判定肝脏转移癌是否为可手术切除的标准在于保留足够正常肝储备功能的基础上是否能获得阴性的手术切缘即R0切除[ 1, 2, 3]。肿瘤大小极少成为手术切除的禁忌证。因为可切除性的终点关注的是肿瘤通过手术获得治愈的潜在可能性[ 4]:只有当手术能完全切除所有已知病灶时才能考虑手术,因为已经有证据表明肝脏转移灶的部分切除或减瘤手术对生存率没有好处[ 1, 5]。
马冬(肿瘤内科主任医师):这个病例诊断为直肠癌并肝转移,Ⅳa期是明确的。转移性结直肠癌确诊时大多数属于初始不可切除。然而,对那些转移瘤仅局限于肝脏且不可切除的患者,目前越来越倾向于使用术前化疗来缩小转移瘤体积以便将其转化为可切除(即转化性化疗)。该病例的肝脏转移病灶属于可切除的范畴,同期与分期切除都可以考虑,考虑直肠癌浸润肠壁将近70%,有潜在的梗阻可能,肿瘤距肛门13 cm,若先行新辅助治疗,肿瘤可能进展,可能还会失去保肛的机会,所以建议先行一期手术切除原发灶。
吴一龙(肿瘤学教授):从理论上来讲,Ⅳ期肿瘤患者就意味着体内肿瘤存在血道转移。那么从整个肿瘤学理念来讲,先行新辅助化疗应该是比较合理的选择。但是这个病例是单独的肝转移,若能行手术切除,它的预后和Ⅲ期相差不大。这就让我们思考一个问题,这一类的病人,是不是跟我们传统上的Ⅳ期不一样,也就是说它仍然以局部发展为主,新辅助化疗也不一定很必要。所以,我觉得这个病例好像先行新辅助化疗与先行手术治疗两种治疗策略都可以选择。
李勇:EORTC 40983 Ⅲ期研究试验提示[ 6], 采用FOLFOX4围手术期化疗在可切除的结直肠癌肝转移患者中,与单纯手术比较改善了3年无进展生存期;使得部分患者避免了不必要的手术;合并症虽然增多但死亡率并不增高;多学科团队合作有利于患者获得最佳治疗;可以推荐为新的标准治疗方法。术前化疗的潜在优点包括:及早治疗微小转移灶;判断肿瘤对化疗的反应(具有预后价值,有助于制定术后治疗计划);对那些早期进展的患者可以避免局部治疗。而新辅助治疗潜在的缺点包括:化疗诱导的肝损伤;错过了“手术机会的窗口期”,可能因为肿瘤早期进展,也可能因为化疗获得完全缓解而使手术切除范围的确定变得异常困难[ 7, 8, 9]。当时我们考虑到患者肠镜活检后原发灶有出血,且有潜在的梗阻可能,在新辅助化疗和手术治疗之间就选择了行手术治疗。再考虑到原发灶和转移病灶对化疗敏感性可能存在差异性,且Martin等[ 10]报道了同期结直肠癌并肝转移中可切除肝转移的病例,同期切除与分期切除围手术期死亡率差异无统计学意义,同时考虑手术切口的选择等因素,我们最终选择了行分期手术治疗。于2010年3月17日行直肠癌原发灶的根治术,术中见肝脏表面分别在S5和S8段可触及两肿物,大小分别为: 1.5 cm×1.5 cm和4 cm×3 cm,盆腔、肠系膜、肝脏、胃、腹壁等处无转移性结节。直肠肿块上极在腹膜反折处以上,活动度可,直径约5 cm,质中,已浸润至直肠浆膜层。术程顺利,术中出血100 mL,麻醉满意,术后安返病房。现在请病理科专家解读一下病理结果。
李丽(病理科医师):术后送检标本见直肠12 cm肠管一段,距一端切缘2 cm处见3.5 cm × 2.5 cm × 1.5 cm隆起肿物,边界不清。肿物切面灰白,质中,浸润肠壁全层。距肿物1.5 cm处见 1.5 cm × 1 cm × 0.5 cm息肉样隆起。系膜扪及结节19枚,直径0.1~0.3 cm。病理诊断:(直肠)中分化腺癌;(病理)分期:pT3N2(TNM);IHC: p53(++),Ki67 (60%+),ECD(++), CD44s(+), CerbB2(-),Bcl2(-),EGFR(+),ERCC1(-),COX-2(-), ER(-);基因序列分析报告:K-RAS基因外显子2和外显子3未检测到突变。
旁述:有大量文献表明编码K-RAS基因的第2外显子中12及13密码子的突变预示了对于西妥昔单抗及帕尼单抗的治疗无效。所以专家组强烈推荐所有在诊断时为Ⅳ期的转移性患者都应行肿瘤组织的基因测序(原发肿瘤或转移病灶)。所推荐的K-RAS基因特定位点测序并不是要指导一线治疗的方案选择,而是为后续治疗方案的选择做计划,所以这项检测并无时间限制,医生应该重视K-RAS基因突变的意义,如果有突变,也应该同时提供其他治疗的选择。K-RAS基因突变是结直肠癌发生中的早期事件,故K-RAS基因突变状态在原发肿瘤与转移肿瘤中表现为高度一致性。正因如此,K-RAS基因型测序既可以选择原发瘤组织也可以选择转移灶组织。
李勇:现在原发直肠癌病灶已经切除,对于现在可切除的肝转移病灶我们下一步的治疗方案是采用5FU/LV单药,还是FOLFOX、FOLFIRI、XELOX联合用药或生物治疗(Cetuximab或Avastin)?
马冬:对于这个中年患者,能够耐受高强度治疗,多药联合化疗比单药方案要好。对于有肝转移病灶的病例,可联合生物靶向治疗。加上生物靶向治疗无论是从手术切除率还是总体生存率上讲,都是能够获益的。现在的靶向药物包括以贝伐单抗(Avastin)为代表的血管内皮生长因子抑制剂和以西妥昔单抗(Cetuximab)及帕尼单抗为代表的表皮生长因子受体抑制剂,那么究竟选哪种联合用药方案加生物靶向治疗呢?其实,不是每一种化疗方案都可以和生物靶向治疗联合的。若不考虑靶向治疗的话,首选FOLFOX方案,而不选FOLFIRI方案,虽然说它们在晚期结直肠癌合并肝转移的治疗中都可以用于一线治疗方案且被交叉用于二线化疗时,对总体生存率影响是没有差异性的,但是前者在用于转化性治疗时的有效率是明显高于后者的。若考虑联合生物靶向治疗,就要首选FOLFIRI方案了。因为FOLFOX联合贝伐单抗没有带来更高的有效率,若FOLFOX联合西妥昔单抗时可能会获得更高的有效率,但是对于总体生存率是不影响的。若FOLFIRI联合西妥昔单抗对可切除的直肠癌肝转移灶来说,有效切除率可达到30%以上。
林锋:我认为,这个病人只有一种选择。对于可切除的肝转移病灶,一般不考虑使用FOLFIRI,也断然不会使用单药,因为它是Ⅳ期病人,用5FU反应率太低。而FOLFIRI对肝的副作用较大,可引起肝细胞变性(称为“黄肝”),肝细胞的变性会影响外科医生手术时切除病灶的范围,也会影响到术后残余肝脏的生理功能。奥沙利铂主要引起肝窦的改变(称为“蓝肝”),而肝窦的病理改变对肝脏手术影响不大。所以在这个病例中,我认为使用FOLFOX方案较为合理。
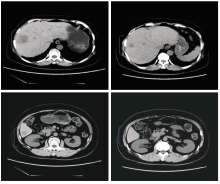
李勇:我们考虑XELOX方案较FOLFOX方便。最终,我们选用了XELOX方案加西妥昔单抗。考虑以下几点:新辅助化疗方案的选择一般都参照晚期一线结直肠癌化疗的原则,一般来说是选择一个联合两种药物以上的化疗方案,对于这种本身属于可切除的肝转移病灶,它不需要很强的反应率;再从安全性来看,XELOX与西妥昔单抗副作用都较小。患者术后4周予XELOX+西妥昔单抗化疗3周期,过程顺利,轻度皮疹,食欲下降。化疗后评估:CEA和CA199明显下降,腹部CT提示肝脏占位较前缩小(如 图1所示);我们现在已经化疗完3个周期了,现在是否停止化疗,进行二次手术,还是继续化疗?
林锋:假如最大肝脏转移灶超过5 cm,化疗若能使其小于5 cm后就可行手术治疗;对于这个小于5 cm的转移病灶,化疗过程中一旦出现化疗副作用,则可行手术治疗。
李勇:基于现有的资料,对于可切除的病灶,在放疗、介入、外科手术中首选外科治疗。我们选择了肝胆外科手术。在结直肠癌肝转移病例中,如果肝脏转移灶是可以切除的,那么手术是其治愈的唯一方式。无论是不治疗,还是单纯化疗,患者的5年生存率都不到2%,而只有通过手术切除肝转移灶,才可以显著提高5年生存率到40%,使患者获得长期的生存[ 11]。在2010年7月13日,肝胆肿瘤外科医生行肝部分切除术,术后病理诊断肝S1、S5、S8为转移性中分化腺癌,结合免疫组化及病史,符合直肠腺癌肝转移。令人出乎意料的是K-RAS为突变型。我们请病理科专家来对这一现象作解释。
李丽:一般来讲,原发灶和转移灶K-RAS基因检测的一致率为90%左右。如果不一致,主要考虑在肿瘤细胞转移的过程中获得了一个K-RAS突变的可能。或者在原发肿瘤中,K-RAS突变型的异质性细胞含量少,基因检测未检测到,而在转移灶中这种异质性细胞含量较多 ,可以被检测到。
李勇:第二次手术后,考虑到K-RAS为突变型,无法联合西妥昔单抗,则予XELOX方案化疗5个疗程。化疗过程顺利,无明显毒副作用。化疗后进入随访期,CEA处于正常范围内,直到2010年12月行全腹CT检查也未发现复发迹象。2011年4月,CEA开始上升,行PET/CT复查提示肝内存在新发病灶约1 cm × 1 cm,考虑新发灶为转移瘤可能性大;肺内存在结节,不排除为转移瘤。这时,我们应该采取什么措施呢?
马冬:现在肝肺都可能存在转移病灶,可能要选择行高强度的化疗方案,可以采用FOLFIRI方案行化疗,待转移灶缩小以便行手术或介入治疗。
李勇:从2011年5月1日开始采用FOLFIRI方案化疗,化疗过程中出现了呕吐、腹泻、脱发、手足脱皮等明显毒副作用。化疗3个疗程后再次行胸腹部CT提示肝脏S7存在转移灶约0.6 cm×0.6 cm,较化疗前缩小,且CEA、CA199也下降到正常范围内。下一步我们该选择什么治疗方式呢?
陆骊工(介入科主任医师):虽然手术是可切除转移瘤患者的标准局部治疗方法,然而有些患者由于转移瘤的位置不好而不能切除,在这种情况下我们可以采用消融技术治疗。结合这个病例,考虑到解剖部位以及肿瘤较小,可以采用消融治疗。
李勇:在2011年7月,我院介入科专家在CT定位下行肝转移病灶的射频消融术。消融后CT评估效果满意。考虑到患者使用FOLFIRI方案副作用较大,停用该方案。而肺内存在可疑的转移病灶,我们在术后采用了2个疗程的卡培他滨单药口服化疗。术后进入随访,在2011年12月发现CEA升高,行胸腹部CT提示肝脏S7段转移病灶未见强化,说明肝脏的转移灶已经处于静止期,但是右上肺叶后段出现新发小结节,考虑转移瘤。胸外科医生于2011年12月在胸腔镜下行右上肺楔形切除术,术后病理报告:右上肺腺癌转移、K-RAS呈突变型。术后随访,于2012年2月行PET/CT提示肝S7结节增大,且呈高代谢状态,考虑行射频消融的肝脏S7转移病灶进展,右肺未见新发转移。肝胆肿瘤外科医生再次行肝部分切除术,术后病理提示肝腺癌,符合大肠来源,为转移癌,K-RAS呈突变型。现在患者处于密切随访中,CEA处于正常范围内,目前还未发现有新发病灶。
林锋:通过胃肠肿瘤外科、肝胆肿瘤外科、肿瘤介入科、肿瘤内科、放射科、病理科等多学科团队的合作,我们已经把所有的治疗方式都应用在该病例上,到目前为止,我认为没有固定的标准治疗方式。该病例虽然每次对一种新的化疗方案都有一定的初始疗效,但维持疗效欠佳,平均8个月左右就出现新发病灶,出现耐药的时间较短。对于这个病例,现在可以采取一种“不见兔子不撒鹰”的策略,即在随访的过程中,一旦发现新发病灶,我们则采取相应的治疗策略,如化疗、外科手术或介入消融等。
总结一下,由于技术手段、治疗理念以及化疗药物的更新,包括肝肺转移瘤在内的可以完全切除(R0)的结直肠癌合并肝肺转移Ⅳ期病例,其疗效越来越好,治愈率明显提高,手术后5年生存率在35%~50%以上,与Ⅲ期患者相似。这让我们思考以下两个问题。
一方面,可切除的Ⅳ期与Ⅲ期患者在生存率方面可以达到接近,说明目前的结直肠癌分期系统(AJCC)可能存在一些问题。如:不能准确反映疾病的本质;不能正确反映疾病预后;不能正确预测疾病的转归,可能需要进一步修正。这就让我们迫切需要一种针对Ⅳ期结直肠癌的新的分层分期系统。近年来全球很多机构也开始了对结直肠癌肝转移新分期的探讨,尤其以欧洲的研究最受关注。其中以Bilchik等的网格分期系统最受关注,它将结直肠癌肝转移的分类进一步细化,最大程度提供了各亚组群体的预后信息及治疗意向信息,值得我们推荐。
旁述:2006年欧洲结直肠癌转移瘤治疗协作组(ECMTG)提出了新的分期方法,其主要是根据转移瘤范围(仅有肝/肝外)和是否可切除分为Ⅳ期和Ⅴ期,该新分期方法认为一旦转移超过肝脏范围,可以列入Ⅴ期,这有点过于繁琐且与当前的肿瘤Ⅰ~Ⅳ期主流分期不符,但其能为治疗及预后提供信息[ 12]。同年,Poston等提出另一种分期方法,首先根据是否可切除分为4R和4U,然后又根据肝/肝外分为a、b、c三个亚组,其基本共识就是要把肝转移按照“可切除性”细分为可切除、潜在可切除和不可切除三个亚组[ 13]。Bilchik等在2008年提出了网格分期系统,该分期系统将代表转移的M分期根据疾病累及程度和范围细分为M1~M4,分别代表仅有肝转移、可切除肝外转移、初始不可切除肝外转移和不可切除肝外转移;而肝转移还根据是否可切除分为a、b、c三个亚组。然后根据疾病所落在地网格位置来决定期别,并给出相应的推荐治疗方法。从原来的“不可切除”亚组中细分出一组“潜在可切除”群体,就是得益于有效的化疗使得初始不可切除的部分患者转化为可切除(转化性化疗)[ 14]。
另一方面,可切除的结直肠癌肝肺转移在治疗上应该与没有根治机会的广泛性结直肠癌肝肺转移不同,但由于现在很少有大型Ⅲ期随机对照试验结果作为循证医学证据,因此,其治疗模式越来越向Ⅲ期结直肠癌看齐,根治性同期或分期切除原发灶及转移灶+围手术期(术前新辅助+术后辅助)化疗,现已经成为公认的治疗模式。虽然关于化疗联合手术、化疗持续时间、化疗方案的选择、手术时机的选择目前仍有争论,对于初始可切除性肝转移患者,已经将围手术期化疗作为这类患者的标准治疗方案,并推荐在最多6周期全身化疗后手术。对于接受术前全身化疗的初始无法切除性肝转移患者,应严密监测随访,一旦转移病灶转为可切除,立即行手术治疗。所有患者都应该接受多学科团队的综合治疗。
总之,这个病例只是个体化的案例,现在回顾一下可能或多或少有一些得失。我们要做的就是将循证医学和个体化治疗有机地结合起来,紧跟结直肠肿瘤的最新进展。加强多学科团队合作,在探索中寻找规范化的治疗。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|