引用本文

中国抗癌协会肺癌专业委员会执笔:吴一龙, 廖美琳, 周清华, 蒋国樑, 陆舜, 王洁, 程颖, 张力, 张绪超, 刘晓晴, 韩宝惠, 钟文昭, 周彩存, 宋勇, 马胜林, 王长利, 杨学宁, 毛伟敏, 王俊, 许林, 陈海泉, 傅小龙, 冯继锋, 宋启斌, 于世英, 伍钢, 朱广迎, 陈公琰, 熊建萍, 杨衿记, 王建军, 陈克能, 申屠阳, 张沂平, 胡艳萍, 于丁, 宋恕平, 胡成平, 宋向群, 常建华, 陈刚, 张贺龙, 李伟雄, 王震. 非小细胞肺癌小分子靶向药物耐药处理共识.循证医学, 2013, 13(2): 65-69
WU Yi-long, LIAO Mei-lin, ZHOU Qing-hua, JIANG Guo-liang, LU Shun, WANG Jie, CHENG Ying, ZHANG Li, ZHANG Xu-chao, LIU Xiao-qing, HAN Bao-hui, ZHONG Wen-zhao, ZHOU Cai-cun, SONG Yong, MA Sheng-lin, WANG Chang-li, YANG Xue-ning, MAO Wei-min, WANG Jun, XU Lin, CHEN Hai-quan, FU Xiao-long, FENG Ji-feng, SONG Qi-bin, YU Shi-ying, WU Gang, ZHU Guang-ying, CHEN Gong-yan, XIONG Jian-ping, YANG Jin-ji, WANG Jian-jun, CHEN Ke-neng, SHEN Tu-yang, ZHANG Yi-ping, HU Yan-ping, YU Ding, SONG Shu-ping, HU Cheng-ping, SONG Xiang-qun, CHANG Jian-hua, CHEN Gang, ZHANG He-long, LI Wei-xiong, WANG Zhen. The Consensus of Non-Small Cell Lung Cancer with Small Molecular Targeted Drug Resistance.
Journal of Evidence-Based Medicine, 2013,13(2): 65-69

Copyright©2013 《循证医学》杂志 版权所有
The Consensus of Non-Small Cell Lung Cancer with Small Molecular Targeted Drug Resistance
2013年3月8-9日,中国抗癌协会肺癌专业委员会和中国抗癌协会临床肿瘤学专业委员会(Chinese Society of Clinical Oncology,CSCO)联合主办了第十届“中国肺癌高峰共识会”,来自全国的600多位专家,讨论了肺癌小分子靶向药物的耐药机制和应对策略。专家们认为,小分子靶向药物是肺癌治疗史上的里程碑事件,但其无可避免的耐药现象,成为进一步提高靶向药物疗效的瓶颈。深入了解小分子靶向药物的耐药机制,根据耐药机制和临床规律制定相应的应对策略,是指导小分子靶向药物合理应用的当务之急。经过详细的讨论和思辨,最终形成了非小细胞肺癌(non-small cell lung cancer,NSCLC)小分子靶向药物耐药处理共识。
本共识的共识级别为:
1A级:基于高水平证据(严谨的Meta分析或RCT结果),专家组有统一认识;
1B级:基于高水平证据(严谨的Meta分析或RCT结果),专家组有小争议;
2A级:基于低水平证据,专家组有统一认识;
2B级:基于低水平证据,专家组无统一认识,但争议不大;
3级:专家组存在较大争议。
1 共识一: EGFR突变型肺癌,建议检测BIM,以发现原发性耐药患者共识级别:3。
BIM全名为BCL-like 11,也称Bcl-2-interacting mediator of cell death,为BCL-2蛋白家族成员,是活性最强的促凋亡蛋白之一。表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)吉非替尼和厄洛替尼需通过BIM的上调才能引起带有EGFR突变的肺癌细胞的凋亡,其中编码的BH3(the pro-apoptotic BCL-2 homology domain 3)被称为唯一的促凋亡蛋白[ 1]。东亚人群中BIM基因的2号内含子存在缺失多态性,导致这一人群表达的是缺乏促凋亡活性的BIM亚型(BH3缺失),从而引起对EGFR TKI的原发耐药或削弱TKI的临床疗效。有报道中国患者的BIM del 多态性携带率为12.3%(75/608),EGFR突变患者的携带率为18.4%(26/141)[ 2]。人类基因组单倍体图(Hap Map)计划中的中国人BIM del携带率为20.5%。广东省肺癌研究所吴一龙团队检测了169例肺癌患者的BIM基因,也发现24.3%(41/169)的患者存在BIM del多态性。相比而言,德国或欧洲人群则未见BIM del这种多态性。Ng等[ 2]研究了BIM del 多态性和TKI 治疗反应相关性,结果显示,BIM缺失多态性的EGFR突变型肺癌患者对TKI的治疗反应显著低于野生型患者,无进展生存期较非缺失患者明显缩短(6.6个月 vs. 11.9个月, P=0.002 7),BIM多态性是潜在的NSCLC EGFR TKI疗效预测因子。
最近的研究提示,抗微管的细胞毒药物如紫杉类能有效作用于BIM的过表达,由此可考虑相应的克服BIM原发性耐药的方法[ 3]。
52.1%的与会专家赞同治疗前应检测BIM以判断是否出现原发性耐药。
2 共识二:对EGFR TKI耐药的突变型肺癌,建议重新活检以明确耐药的分子机制,鼓励患者参加相应的临床试验共识级别:2A。
对EGFR TKI耐药产生的机制,目前有两种观点,一是获得性模型(也称获得性突变),指的是长期使用EGFR TKI后药物诱发的突变或旁路激活,如守门基因T790M的突变,其证据是体外EGFR突变敏感细胞株PC-9与吉非替尼长期培养可诱导出T790M的突变而成为PC-9R耐药细胞株。二是选择性模型(也称克隆选择),指的是在未治的肿瘤中已存在占优势的敏感和少数的耐药细胞,长期用药后敏感细胞被杀灭而原来少量的耐药细胞被选择出来成为优势细胞[ 4]。目前越来越多的证据支持选择性模型。
目前最常见的耐药机制是T790M,约占50%。T790M为EGFR的20号外显子(Exon20)第790位点上的苏氨酸(threonine)为蛋氨酸(methionine)所取代。分子模拟提示T790M改变了ATP的亲和性,导致EGFR TKI不能有效阻断信号通路而产生耐药[ 5, 6]。如果采用比直接测序法更为敏感的方法检测未经治疗的EGFR突变型肺癌,31.5%的患者可同时存在T790M,但这些患者同样对EGFR TKI敏感,因此,治疗前低丰度的T790M不影响EGFR TKI的应用,但可提示其发展趋势和耐药机制[ 7]。需注意的是,T790M可和其他引起耐药的分子事件如C-Met同时存在,这大大增加了治疗的难度。
5%~20%的EGFR TKI耐药是由C-Met所引起。不同于T790M,C-Met主要是通过肝细胞生长因子配体旁路激活信号通路从而导致耐药[ 8]。C-Met异常可表现为突变、扩增、过表达,由于形式多样,如何检测、如何界定截断值、是否可作为疗效预测因子,均存在许多未解决的问题。
其他引起耐药的机制还有小细胞肺癌转化(6%~14%)、PI3K旁路激活(<5%)等,30%左右的耐药还找不到原因[ 9]。目前针对大部分耐药机制的临床试验正在进行中(见 表1)[ 10]。
表1
表1
 表1 基于耐药机制的临床试验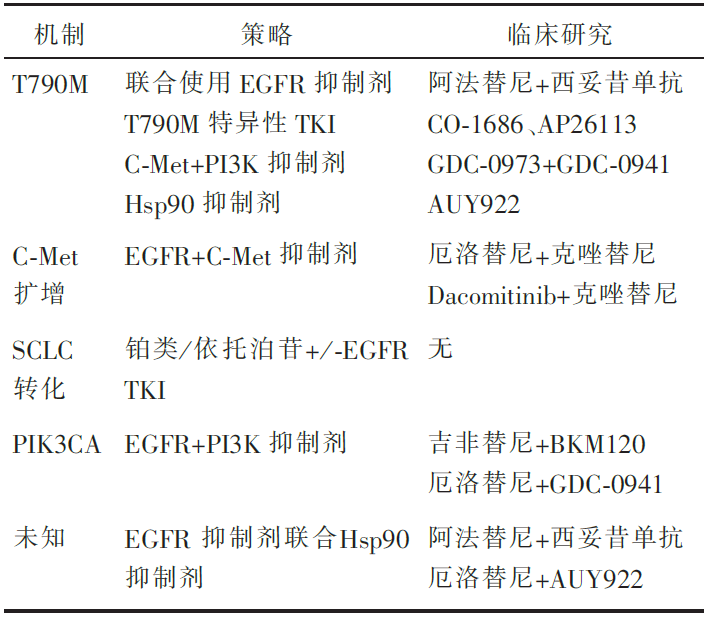 | 表1 基于耐药机制的临床试验 |
88.8%的专家赞同对耐药的患者应再次活检以明确耐药机制。
3 共识三:对EGFR TKI继发耐药的无症状缓慢进展突变型肺癌,建议继续使用EGFR TKI共识级别:2B。
2010年美国的Jackman等提出了EGFR TKI获得性耐药的临床定义,该定义的核心是有EGFR敏感突变患者服药后取得完全缓解或部分缓解、或是用药后稳定在6个月以上后出现进展的患者[ 11]。我国的Yang等在此基础上,根据使用EGFR TKI的时间、肿瘤负荷和肿瘤相关症状三个变量,进一步将EGFR TKI进展的患者分成缓慢进展、局部进展、快速进展三种类型并提出了相应的处理策略[ 12]。
无症状缓慢进展的临床定义为:EGFR TKI对疾病的控制时间超过6个月;原有的肿瘤病变略有增大或出现1~2处新的非靶病灶;没有症状或症状没有变化。对此类患者,许多专家认为属于癌基因成瘾,此阶段停药可能会出现疾病暴发进展[ 13],继续服用EGFR TKI效果似乎好于改为化疗[ 12]。日本的一项134例的回顾性研究显示,进展后继续使用吉非替尼的中位无进展时间3.2个月,中位总生存时间14.3个月[ 14]。广东省肺癌研究所26例缓慢进展继续使用TKI的患者,中位总生存期高达39.4个月,另一组转换为化疗的患者,中位生存时间仅17.8个月[ 12]。日本Nishie等的回顾性研究显示同样的结果,继续使用TKI的中位总生存期32.2个月(39例),转换为化疗的中位总生存期23.0个月(25例),生存差异有显著统计学意义[ 15]。但是单独用药还是联用化疗,则尚无定论。2012年美国ASCO年会上报道的一项Ⅱ期临床研究,78例患者入组,改为单用化疗和联合化疗两组的无进展生存期为4.2个月和4.4个月,差异没有统计学意义,但联合化疗组的有效率为41%明显高于单用化疗组的18%[ 16]。韩国Park领导的泛亚洲继续使用吉非替尼的单臂试验(ASPIRATION研究)、法国Soria和香港Mok领导的全球EGFR TKI失败后化疗和TKI联合化疗的头对头试验(IMPRESS研究),将会对此作出回答。
专家组投票,31.9%支持对该类型的耐药继续使用EGFR TKI,54.6%赞同在继续使用TKI的基础上联合使用化学治疗。
4共识四: 表现为孤立进展的EGFR TKI继发耐药,建议在继续使用EGFR TKI的基础上联合应用局部治疗,局部治疗手段的选择以最小创伤为基本原则共识级别:2B。
孤立进展的临床定义为:EGFR TKI对疾病的控制时间超过3个月;疾病进展源于出现孤立的颅外病变或仅限于颅内进展;没有症状或仅有孤立转移病变所引起的症状[ 12]。美国Colorado大学将适合局部治疗的情况归纳为:适合全脑放疗或脑立体反射或手术切除的没有脑膜转移的颅内进展;颅外≤4个病灶、同时适于体部立体放射或常规分割放射或外科切除的进展。他们报道了25例的经验,局部治疗后的中位无进展时间为6.2个月[ 17]。Memorial Sloan-Kettering癌症中心的经验,加上局部治疗后,中位总生存时间达到41个月[ 18]。当然这种情况下也可考虑使用在中国广泛开展的各种介入消融技术。至于选择何种手段,则以最小创伤为原则。广东省肺癌研究所的研究提示,局部进展的原因多数源于肿瘤异质性,即局部进展病变的基因类型不同于受TKI控制的病变,此可称为混合疗效,为靶向药物耐药的一个类型,发生率约为14.7%,可视为使用局部治疗的生物学基础[ 19]。
5共识五:对EGFR TKI获益、继发耐药后接受细胞毒药物治疗再次耐药的EGFR突变型患者,可考虑再程使用EGFR TKI,但不推荐立即转换第二种EGFR TKI共识级别:2B。
TKI再程使用的模式为靶向药物耐药后继以化学治疗,化疗耐药后再次使用原来使用的或转换另一种TKI。依据靶向药物耐药的克隆选择假说,再程使用TKI有其一定的合理性[ 4]。Hata等分析了再程转换TKI治疗耐药的NSCLC,在多因素分析中,如果患者能从首次的EGFR TKI治疗中获益、良好的行为状态和间插化疗的时间越长的患者,越能从再程治疗中获益[ 20]。Namba等[ 21]在2012年的ESMO年会上,报道了最大宗的一项回顾性分析,与没有再程治疗的比较,无论是无进展生存期还是总生存期,再程治疗均取得了有意义的统计学结果,其中总生存期为1 272天vs. 774天。
69.4%的专家在临床实践中再程使用过EGFR TKI。
临床实践中,有医生在一种TKI失败之后立即给患者转换使用第二种TKI。有限的几项回顾性分析均显示,不管是吉非替尼立即转换为厄洛替尼还是厄洛替尼立即转换为吉非替尼,无进展生存期均在2个月左右[ 22, 23]。64.2%的专家不支持这种立即转换TKI的方法,因此本共识不推荐在临床实践中使用。
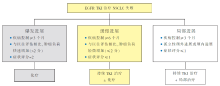
6 小 结EGFR TKI耐药的处理是一个非常复杂的临床难题,目前尚缺乏高级别的循证医学证据。因此,本共识提出的临床管理策略( 图1)仅供临床实践参考。我们提倡临床医生开展更多针对靶向药物耐药的临床试验,也鼓励患者积极地参与到临床试验中。
The authors have declared that no competing interests exist.