目的 系统评价浅表性膀胱癌经尿道术后早期灌注化疗对肿瘤复发及进展的影响。方法检索PubMed、EMBASE、CNKI、VIP及万方数据库,检索时间从建库至2012年4月,收集浅表性膀胱癌经尿道术后早期灌注化疗的随机对照试验。由2名研究者按照纳入排除标准筛选文献,评价质量并应用RevMan 5.0进行Meta分析。结果经过评价共纳入4个随机对照研究,合计909例浅表性膀胱癌患者。Meta分析显示:术后灌注可降低肿瘤复发率(比值比0.46, 95%可信区间0.22~0.99,
Objective To evaluate the recurrence and progression of tumors treated with early intravesical chemotherapy after transurethral resection of non-muscle-invasive bladder cancer (TUR-bt).Methods Randomized controlled trials (RCTs) about early intravesical chemotherapy after TUR-bt were retrieved on PubMed, EMBASE, CNKI, VIP and Wanfang databases from their establishment to April 2012. According to the inclusion and exclusion criteria, two reviewers independently screened the trials, extracted the data, assessed the quality, and conducted the meta-analysis with Revman 5.0 software finally.Results A total of four RCTs involving 909 superficial bladder cancer patients were eligible. The results of meta-analysis showed that there was statistical difference in tumor recurrence(OR=0.46, 95%CI 0.22~0.99
膀胱癌是泌尿系统常见的恶性肿瘤。其中,70%为浅表性肿瘤[ 1]。治疗非浸润性膀胱癌的首选方法是经尿道电切除术(transurethral resection,TUR),然而术后高复发率及进展为原位癌是临床急需解决的难题[ 2, 3]。术后膀胱内行化疗药物灌注已得到广泛应用。许多研究表明,术后行药物灌注能够降低术后复发率并延长进展时间[ 4, 5, 6]; 亦有报道显示,术后早期灌注化疗药物并不能改善患者的临床预后[ 7, 15]。Kikuchi和Frydenberg等[ 11, 14]报道,肿瘤分期及分级的初次诊断是影响肿瘤复发的危险因素。由于临床研究少,浅表性膀胱癌经尿道术后早期灌注化疗对肿瘤的复发及进展的影响尚缺乏循证医学证据的支持。
为给浅表性膀胱癌术后早期化疗药物的灌注提供更高、更可靠的临床依据,我们收集了术后24小时内行化疗药物灌注治疗浅表性膀胱癌的随机对照试验(randomized controlled trial,RCT),并进行了系统评价,以期为临床医师治疗浅表性膀胱癌术后应用化疗药物灌注及对患者生活质量的改善提供循证医学的支持。
RCT,语种限定为中英文。
纳入标准:浅表性膀胱癌患者术后采用化疗药物灌注治疗。诊断标准采用膀胱癌2002 TNM分期法,不受年龄、种族、性别、病程、体重等限制。
排除标准:术后24小时以外的灌注化疗;未经手术直接采用化学药物治疗者;非膀胱灌注方式给药;除化疗药物外有其他干预措施;研究对象患有严重心脏或肾脏功能不全者;对化疗药物过敏或者严重全身反应不能耐受者;患有其他影响试验完成者。无法获取全文及详细摘要的文献,重复发表的文献。
试验组给予化疗药物治疗,对照组不含化疗药物治疗,用药剂量及疗程不限。
主要指标为术后灌注化疗后肿瘤的复发率和肿瘤进展情况,次要指标为不良反应的发生率。
1.5.1检索数据库
计算机检索PubMed、EMBASE,中文检索CNKI、万方数据库、维普数据库。由两位研究者分别独立检索文献,检索年限均从建库至2012年4月。
1.5.2检索策略
英文检索词: superficial bladder cancer、 non-muscle-invasive bladder cancer、 mitomycin C、thiotepa、 gemcitabine、 chemotherapy、 epirubicin、randomized controlled trial。
中文检索词:浅表性膀胱癌、非肌层侵润性膀胱癌、丝裂霉素C、塞替派、吉西他滨、化疗、表柔比星、随机对照试验。
PubMed数据库检索策略为:(“mitomycin C” or“thiotepa” or“gemcitabine” or “epirubicin”)and (“superficial bladder cancer” or “non-muscle-invasive bladder cancer”)。
由两名研究者按照纳入、排除标准独立筛选文献,并按照预先设计好的资料提取表分别提取资料,排除明显不符合纳入标准的试验后,对可能纳入的资料阅读全文。最后交叉核对资料,如遇分歧,通过协商讨论解决。
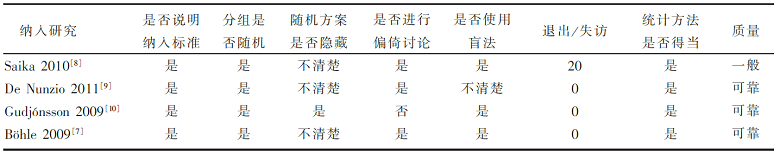
纳入的研究从以下几方面进行质量评估,以考察各研究是否存在偏倚及影响程度:①试验设计是否科学;②研究对象的纳入标准及其基本构成特征是否明确;③处理因素及其方法是否正确;④统计方法是否得当;⑤是否就本研究存在的偏倚进行讨论。以上五项,每满足一项为1分,总分≥3分为质量可靠。
应用RevMan 5.0 软件进行Meta 分析。各临床试验的异质性检验采用χ2检验,如有统计学异质性( P<0.05; I2>50%),采用随机效应模型进行数据合并,计算比值比(odds ratio,OR)及95%可信区间(confidence interval,CI),对可能导致异质性的因素进行分析,必要时,进行亚组分析;如无统计学异质性( P>0.05; I2<50%),采用固定效应模型进行数据合并。
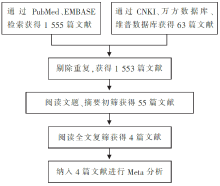
通过检索共获得1 618篇文献,其中中文63篇,英文1 555篇。通过阅读文题、摘要及全文,排除综述、未设置空白对照组及对照组合并其他治疗,以及不是术后24小时内进行灌注化疗的研究,最终纳入4篇随机对照试验。文献筛选流程见 图 1。
2.4.1术后复发率的比较分析
有4项研究进行了膀胱癌术后早期灌注化疗对肿瘤复发率的评估[ 7, 8, 9, 10],共纳入909例病人,其中化疗药物灌注组486例,空白对照组423例。异质性检验结果显示存在较大的异质性( P=0.000 4, I2=84%)。故采用随机效应模型进行合并,结果显示: OR合并 = 0.46, 95%CI 0.22~0.99, P=0.05。表明浅表性膀胱癌经尿道术后行药物灌注对降低肿瘤的复发率有一定的作用,见 图2。
2.4.2术后行灌注化疗后肿瘤进展分析
有3项研究进行了浅表性膀胱癌经尿道术后早期行化疗药物灌注与不灌注对肿瘤进展情况影响的研究比较[ 7, 8, 9],共690例病人,其中化疗组384例,对照组306例。各试验间异质性检验显示: P=0.82, I2=0%,表明无异质性,故采用固定效应模型进行Meta分析。结果显示两组差异无统计学意义(OR=0.59, 95%CI 0.20~1.72, P=0.34),表明浅表性膀胱癌经尿道术后早期行化疗药物灌注,对降低肿瘤的进展及患者的死亡率无明显作用,见 图3。
2.4.3安全性评价
有3项研究报道了化疗药物灌注治疗组出现膀胱刺激征、骨髓轻度抑制、血清转氨酶升高等症状[ 7, 8, 9]。对照组病人仅1例出现发热。各研究间无异质性( P=0.69, I2=0%),采用固定效应模型进行Meta分析。结果显示,两组差异有统计学意义(OR=9.13, 95%CI 2.14~38.98, P=0.003)。表明浅表性膀胱癌经尿道术后早期行膀胱内化疗药物灌注,药物所致副作用对患者产生较大不良反应,见 图4。
浅表性膀胱癌是膀胱肿瘤中发病率较高的疾病[ 1, 12],治疗的目的是阻止或延长疾病的进展。TUR术后行膀胱内化疗药物灌注为临床上常用的治疗方案。较为常用的药物有丝裂霉素、表阿霉素、吉西他滨等,其中,灌注药物的选择及用药方案对患者的临床预后有着重要的影响[ 6, 12, 13]。对浅表性膀胱肿瘤患者使用化学药物预防治疗,能够增强对膀胱癌患者的长期监测[ 16]。因此,通过对浅表性膀胱癌经尿道术后早期灌注化疗与否的临床结局进行比较,可以评价灌注化疗药物对改善患者预后的效果。
理想的试验应是治疗组与对照组患者选择标准一致,化疗药物灌注方案一致。由于本文纳入研究使用的化疗药物不统一、化疗方案不一致,合并的4个研究存在高度的异质性 P=0.000 4, I2=84%[ 7, 8, 9, 10],故采用随机效应模型进行灌注后复发率评估,结果显示浅表性膀胱癌经尿道手术早期灌注化疗对膀胱癌的复发有一定的降低作用。在进展及死亡率方面,有3项研究异质性结果 P=0.82, I2=0%,采用固定效应模型检测结果表明,浅表性膀胱癌经尿道术后早期行灌注化疗不能阻止肿瘤的进展及减少死亡率[ 7, 8, 9]。同时,化疗药物对患者产生的副作用较明显。
本系统评价存在的局限性:目前对浅表性膀胱癌经尿道术后早期行灌注化疗与否的临床对照研究较少,因此本文仅纳入4篇。另外,本文只纳入了英文发表的文献,分析结果可能存在发表偏倚或者其他偏倚。
此系统评价与国内外大多文献报道的结论不相一致,因此需要更多的高质量的、多中心的临床随机对照试验,为临床决策提供更可靠的证据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|