编者按:疾病的正确诊断和合理治疗是患者和医务工作者共同的心愿。在广东省人民医院肿瘤中心,吴一龙教授指导临床医生应用循证医学理论进行肿瘤的多学科综合治疗,开展临床病例讨论。讨论会上各学科共同围绕一个病例或一个病种进行会诊,临床、病理、B超、放射影像等资料齐全,除相关科室提前准备的中心性发言外,到会人员各抒己见,气氛热烈。参会人员受益匪浅,提高了对疑难病例的诊治水平。为了将他们的诊治经验传播出去,让更多的临床医生获益,我刊开辟“循证病例讨论”栏目,希望广大医务工作者关注此栏目。
患者男性,55岁,因“右上肺癌综合治疗后3年”返院复查。患者于2009年9月1日因“咳嗽气促10余天,加重2天”入住我院胸外科。入院诊断为:右上肺肿物,考虑恶性可能性大。入院后完善检查,9月3日PET/CT提示右肺上叶肿块,纵隔内气管前、隆突下、肺门淋巴结肿大并代谢增高,考虑为右上肺周围型肺癌并肺门纵隔淋巴结转移可能性大;9月4日肺肿物穿刺活检病理示:右上肺腺癌。因穿刺标本量太少,并限于当时检测技术,未能行EGFR突变检测。初步诊断为右上肺腺癌并肺门、纵隔淋巴结多站转移(T2N2M0,ⅢA期)。因患者拒绝放化疗、主观意愿强烈,于9月5日起自行开始服用吉非替尼。服用吉非替尼1个月后返院复查胸部CT示:右上肺肿瘤及肺门、纵隔淋巴结明显缩小。2009年10月14日患者于全身麻醉下接受右上肺叶切除、肺门及纵隔淋巴结清扫术。术后恢复顺利。术后病理提示:右上肺腺癌Ⅱ级,腺泡亚型;淋巴结未见转移癌(0/24)。术后病理分期T2N0M0,ⅠB期。术后继续服用吉非替尼1个月。2010年6月21日返院复查,MRI示脑多发转移;胸腹部CT及全身骨显像未见复发转移征象。于8月4日开始行全脑放疗,剂量37.5 Gy/15 F/3 W,同期给予甘露醇+地塞米松辅助治疗。11月2日复查脑MRI,脑转移瘤全部消失。此后定期复查至今。
既往史:强直性脊柱炎10余年;否认高血压病、糖尿病、心脏病病史;否认过敏史。
个人史:无吸烟、饮酒嗜好,无吸毒史。
婚育史、家族史无特殊。
体格检查:T 36℃,P 80 次/分,R 20 次/分,Bp 130/80 mmHg,Wt 68 Kg,H 170 cm,PS 1 分。双肺呼吸音清,无干湿罗音,心率80次/分,律齐,无杂音。腹软,无压痛反跳痛,肝脾未触及,移动性浊音(-)。专科检查:全身浅表淋巴结未触及肿大。右胸部可见长约20 cm 手术疤痕,伤口愈合Ⅰ/甲。头面部无水肿。胸壁未触及肿物。
辅助检查:
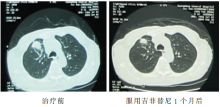
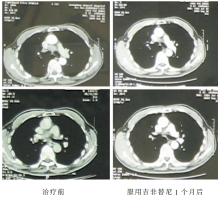
2009-09-02 胸部CT示右肺上叶肿块,大小约29×25 mm,纵隔内气管前、隆突下、肺门淋巴结肿大,最大者约21×28 mm,考虑为右上肺周围型肺癌并肺门纵隔淋巴结转移可能性大,见 图1和 图2。
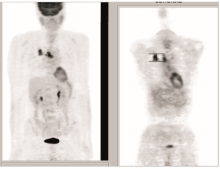
2009-09-03 PET/CT示右肺上叶肿块及纵隔内气管前、隆突下、肺门淋巴结代谢增高,考虑为周围型肺癌并肺门纵隔淋巴结转移可能性大,见 图3;支气管镜示气管及支气管呈炎症性改变。
2009-09-04 肺肿物穿刺活检病理示右上肺腺癌。
2009-10-07胸部CT示右上肺肿物及肺门纵隔淋巴结较前明显缩小。
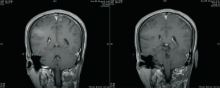
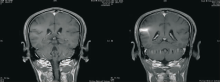
2010-06-21 脑MRI示脑多发转移,见 图4;胸部CT、骨扫描未见肿瘤复发转移。
2010-11-02全脑放疗后复查脑MRI,脑转移瘤全部消失,见 图5。
贲晓松(胸外科主治医师):汇报病史(略)。提出讨论要点:(1)评价本病例的诊断和既往治疗方法;(2)靶向药物用于肺癌新辅助治疗的前景以及目前存在的问题。
吴一龙(肿瘤学教授):术前如何诊断患者为ⅢA期N2的?
陈刚(胸外科教授):肺部原发病灶可以通过肺穿刺活检取得病理。N2的诊断最为准确是病理诊断,可以通过纵隔镜或支气管镜取得。然而纵隔镜和支气管镜均为全麻下的有创操作,有一定的风险,并非所有患者(如本例患者)均能接受。通过治疗前后纵隔淋巴结影像学上的变化,可以从临床上诊断其为N2。
旁述:按照我国《原发性肺癌诊疗规范(2011年版)》及2011年NCCN临床指南,局部晚期非小细胞肺癌是指TNM分期为Ⅲ期的肺癌。采取综合治疗模式是Ⅲ期非小细胞肺癌治疗的最佳选择。将局部晚期非小细胞肺癌分为可切除和不可切除两大类。其中:
(1)可切除的局部晚期非小细胞肺癌包括:
① T3N1的非小细胞肺癌患者,首选手术治疗,术后行辅助化疗。
② N2期肺癌患者的手术切除是有争议的。影像学检查发现单组纵隔淋巴结肿大或两组纵隔淋巴结肿大但没有融合、估计能完全切除的病例,推荐行术前纵隔镜检查,明确诊断后行术前新辅助化疗,然后行手术治疗。
③部分T4N0-1的患者: (a)相同肺叶内的卫星结节,在新的分期中,此类肺癌为T3期,首选治疗为手术切除,也可选择术前新辅助化疗,术后辅助化疗。(b)其他可切除之T4N0-1期非小细胞肺癌,可酌情首选新辅助化疗,也可选择手术切除。如为完全性切除,考虑术后辅助化疗。如切缘阳性,术后行放疗和含铂方案化疗。
④肺上沟瘤的治疗:部分可手术患者,建议先行同步放化疗,然后再手术+辅助化疗。对于不能手术的肺上沟瘤,行放疗加化疗。
(2)不可切除的局部晚期非小细胞肺癌包括:
①影像学检查提示纵隔团块状阴影,纵隔镜检查阳性的非小细胞肺癌。
②大部分T4和N3的非小细胞肺癌。
③T4N2-3的患者。
④胸膜转移结节、恶性胸水和恶性心包积液的患者,新分期已经归类为M1,不适于手术切除。部分病例可采用胸腔镜胸膜活检或胸膜固定术。
吴一龙:ⅢA期N2属于异质性最大的一类患者,临床上再细分为四类:ⅢA1期为术前影像学、术中肉眼判断均未发现N2,术后病理N2;ⅢA2期为术前影像学未发现N2,术中肉眼发现为N2,术后病理N2;ⅢA3期为术前影像学发现单站N2,术后病理N2;ⅢA4 期为影像学发现多站N2。本例患者属于ⅢA4期,直接手术的预后很差,能否先选择放化疗?
李伟雄(放疗科教授):ⅢA期不能手术的患者可以选择同步放化疗,另外部分ⅢA期的患者可以通过放化疗取得降期再行手术治疗。
陈刚:单纯放疗效果如何?多站N2的患者是否会因照射野较大而增加放疗的副反应?
李伟雄:单纯放疗对于ⅢA期N2的患者效果不好,序贯放化疗效果相对要好些,同步放化疗的效果最好。由于同步放化疗副作用相对较大,一般73岁以下及PS评分<2时我们才建议同步放化疗。本例患者隆突下淋巴结肿大,这组淋巴结距食管很近,如果选择同步放化疗,患者放射性食管炎的情况可能会较严重。
吴一龙:这个患者术前选择靶向治疗有何依据?
贲晓松:靶向药物用于新辅助治疗目前尚无十分有力的证据支持,而且患者EGFR突变的情况并不清楚。由于患者依从性太差,坚决不同意放疗和化疗,要求靶向治疗,我们只能根据患者为东亚人、不吸烟、病理腺癌的特点同意他服用吉非替尼。
吴一龙:将一个好的药物用于其适应证以外的时候必须十分慎重。目前,大多数靶向治疗所取得的经验,都是在晚期病例中获得。将靶向治疗用于ⅢA期,是否能获得跟晚期病例同样高的有效率,目前仍有疑问。当遇到这一类超出药物适应证、而我们对于这个药物的认识还不够全面深入的时候,我们应该首先明确,医生不应该成为主导者,此时,患者的知情同意就显得尤为重要。
杨衿记(肺科主任医师):患者术后病理分期为T2N0M0,ⅠB期,术后是否应该加上后续治疗?
陈刚:患者是在服用靶向药物、降期后做的手术,术后是否接受后续治疗应当按照术前的分期来决定。
李伟雄:术后是否加上放疗,我们主要是根据术后的病理报告来定。如果术后病理纵隔淋巴结有转移,那么我们认为是需要术后放疗的。本例患者术后病理纵隔淋巴结并无转移,我认为不需要术后放疗。
吴一龙:目前胸外科对于纵隔淋巴结的清扫可以用骨骼化来形容,那么放疗科对于N2的肺癌病人术后做放射治疗是基于哪些考虑?
李伟雄:一方面是对于可能存在的亚临床病灶的预防性照射,另一方面是对纵隔淋巴结清扫的彻底性存在担忧。
贲晓松:患者出现脑转移后,治疗的手段有哪些?效果如何评价?
谢松喜(放疗科副主任医师):非小细胞肺癌脑转移行放疗的情况大致分三种: (1)全脑放疗,适应于多发的脑转移; (2)立体定向放射外科,包括X刀与γ刀,适用于1~2个脑转移瘤;(3)三维适形放疗。EGFR突变的患者,接受脑部放疗加上靶向药物治疗,其中位生存期可达到12个月。我院肿瘤中心目前有一项关于非小细胞肺癌多发脑转移的临床研究,根据患者EGFR突变的情况进行分组:如果患者为腺癌、EGFR没有突变则直接行全脑放疗;如果EGFR突变但既往服用过靶向药物,也接受全脑放疗;如果EGFR突变且既往未服用过靶向药物,则有症状者可选择靶向药物或全脑放疗,无症状者可选择靶向药物治疗。本病例为多发脑转移,且既往已经服用过靶向药物,所以我们选择了全脑放疗。从放疗前后的脑MRI对比来看,患者全脑放疗的效果非常好,脑转移瘤基本消失。
陈刚:厄洛替尼与吉非替尼这两个靶向药物对非小细胞肺癌脑转移的疗效有无差异?靶向治疗用于早期肺癌的治疗目前国内外有没有什么经验?
吴一龙:目前的文献报道认为,吉非替尼进入脑脊液的浓度足以抑制脑转移瘤的生长,而厄洛替尼进入脑脊液的浓度要高于吉非替尼[ 1]。所以有观点认为治疗非小细胞肺癌脑转移瘤,厄洛替尼疗效要优于吉非替尼。
钟文昭(肺科副主任医师):本病例属于非常典型的ⅢA期N2的非小细胞肺癌患者,可以说是“照书生病”。目前,靶向药物主要用于晚期肺癌,用于新辅助治疗仍然是适应证以外的用药。国外有文献报道:靶向药物用于早期非小细胞肺癌的新辅助治疗,并不会增加术后支气管瘘的风险,然而其有效率只有50%,低于使用于晚期的70%[ 2]。国外也有靶向药物用于ⅢA期N2的很多个案报道,尚无前瞻性研究[ 3, 4]。在众多报道中,脑转移是治疗失败最常见的原因。总体而言,靶向药物用于早期肺癌与用于晚期肺癌有一些差异:(1)一般而言,肿瘤越到晚期其异质性越强,药物的有效率应当不如早期,但靶向治疗的情况却正好相反;(2)晚期患者使用靶向药物,一般使用到肿瘤进展为止,而在早期,比如新辅助治疗后接受手术治疗,术后便存在停药的问题,目前肿瘤的转化性研究提示:靶向药物停药后有可能出现反弹效应。靶向药物用于早期肺癌目前还存在许多不确定因素。
吴一龙:今天我们分享了一个局部晚期非小细胞肺癌治疗比较成功的病例,并且提出一个严肃的问题:适应证以外用药的问题。关于这问题,目前国内有严格的法律法规对其进行限制。从法律的角度看,适应证以外的用药是不允许的;但从科学的角度讲,大家的共识是过于限制适应证以外的用药,医学是无法发展的。在第一届全国抗肿瘤药物的合理用药大会上,陈晓媛博士的专题报告专门讲到了这个问题并得到了大家的共鸣。总结起来有几点:(1)一般情况下,须严格按适应证进行治疗;(2)适应证以外的用药必须满足以下几个条件:(a)国内文献上曾报道过,(b)严格执行知情同意并需要医院一级伦理委员会通过,(c)积极主张研究者发起临床试验(允许科学探索并经伦理委员会批准)。以往我们可能不太注意这个问题,如果出现医疗纠纷我们将落于下风。类似今天的病例,我们从科学的角度是鼓励的,但从今天起,我们应当意识到科学探索是需要有一套东西来组织的。所以,类似今天的病例,尽管是患方自行用药,但我们今后应当尽量将其纳入到相应的临床研究中去。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|