| 上海交通大学附属上海胸科医院副院长、博士生导师、呼吸内科学科带头人,内科教研室主任,复旦大学肺病学博士,国务院特殊津贴享有者。上海市优秀学科带头人,上海市胸科医院药物试验管理机构主任,CSCO执行委员,CSCO肿瘤血管靶向治疗委员会主任委员,中国医师学会肿瘤专业委员会常委,上海市医学会肺科专科委员会委员、肺癌组组长,中国抗癌协会肺癌专业委员会委员,上海市抗癌协会理事。曾在美国匹兹堡大学、MD Andenson医学中心、哈佛大学及香港中文大学学习和进修。参与中国肺癌治疗指南(CNCCN)、卫生部《原发性肺癌诊治规范》及肺癌临床路径制定。2012年任卫生部《原发性肺癌诊疗质量控制指标(试行)》编写专家组成员,参与中国肺癌EGFR、ALK基因检测专家共识的起草工作。担任卫生部内镜专业培训基地考评专家和基地主任,卫生部呼吸内镜专业委员会常务委员。参加数十项国际多中心研究,如IPASS、EAP、INFORM、EAST、INTEREST、ENSURE、Lifenox、MOK-806、CCTC、INSPIRE等,2012年作为全球肺癌分子流行病学研究(IGNITE)的4位全球主要研究者(PI)之一负责亚洲地区的研究。担任《中华呼吸和结核杂志》、《肿瘤》、《循证医学》等10余家杂志编委,《Annals of Oncology肺癌分册中国版》主编。带教博士、硕士研究生30余名。 承担课题:国家科技支撑“十一五”攻关《非小细胞肺癌规范化治疗多中心协作研究》子课题负责人,国家自然科学基金课题、上海市科委重大课题、上海市新兴前沿课题等多项研究。发表有关肺癌研究论文、综述、述评170余篇,其中SCI文章20余篇。主编《肿瘤生物免疫靶向治疗》、《超声支气管镜技术》、《超声支气管镜引导下的经支气管针吸活检》专著;主译《抗肿瘤新生血管治疗》,参编专著10余部。3次获上海市医学科技二、三等奖。 |
Friboulet L, Olaussen KA, Pignon JP, et al. ERCC1 isoform expression and DNA repair in non-small-cell lung cancer[J]. N Engl J Med,2013,368(12):1101-1110.
2a。
•核苷酸切除修复交叉互补基因1(excision repair cross-complementation group 1,ERCC1)蛋白表达是非小细胞肺癌(non-small cell lung cancer,NSCLC)以铂类为基础化疗疗效的一个潜在性预后生物标志物。
•目前虽然有几个研究正在观察ERCC1的表达水平,但是其评价方法仍存在争议。
•ERCC1基因通过不同连接形式产生四种亚型,分别定义为ERCC1-201、ERCC1-202、ERCC1-203、ERCC1-204。目前NSCLC细胞株和肿瘤中不同ERCC1转录子的表达水平及其DNA修复功能未知。
•验证免疫组织化学法(immunohistochemistry, IHC)观察到的ERCC1蛋白表达对化疗疗效的预测作用。
•运用不同抗体标记的IHC观察ERCC1亚型表达及其功能。
•研究条件:加拿大国家癌症研究所临床试验,国际辅助肺癌研究(International Adjuvant Lung Trial, IALT)生物学试验等。
•研究起止时间:1994-2012年。
•研究方法:多中心回顾性研究。
•研究对象:494名患者来自加拿大国家癌症研究所JBR.10组临床试验(314名)和肺顺铂辅助评估生物学研究癌症和白血病B组9633试验(180名);589名患者来自IALT生物学试验,123名患者接受化疗治疗后产生耐药。
•干预措施:用8F1抗体标记的IHC分析验证队列中ERCC1表达对化疗疗效的预测作用;通过不同ERCC1抗体观察ERCC1蛋白亚型,绘制抗原决定基序列图;分别用RT-PCR和Western blot分析NSCLC细胞株和123例化疗耐药肿瘤组织中ERCC1 mRNA和蛋白的表达情况;构建不同亚型表达的模型,观察ERCC1蛋白各个亚型的功能意义。
•评价指标:百分率;总生存率(overall survival,OS);死亡风险比(hazard ratio,HR)。
6.1 8F1抗体标记的IHC验证ERCC1蛋白的表达及其对化疗疗效的预测作用
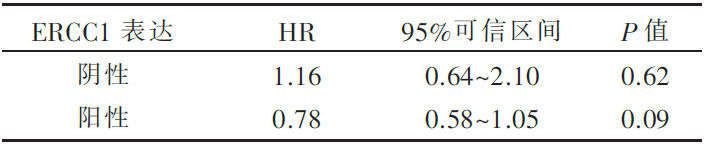
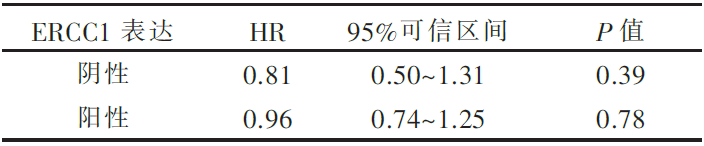
494名患者中78%及589名患者中77%的肿瘤标本ERCC1确认为阳性(H评分>1),ERCC1表达与否对化疗疗效的预测作用见 图1和 表1、 表2,两组验证集均未能证实ERCC1表达对化疗疗效的预测作用( P=0.23, P=0.53)。
| 表1 494名患者ERCC1表达情况对化疗疗效的分析结果 |
| 表2 589名患者ERCC1表达情况对化疗疗效的分析结果 |
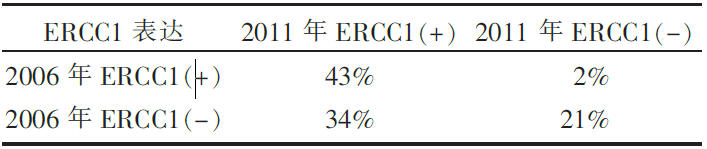
IALT 验证队列中,免疫组化分析ERCC1表达所用的8F1抗体批次与之前不同,36%的标本前后ERCC1表达不一致(见 表3),提示不同批次8F1抗体性能的差异。
| 表3 不同批次8F1抗体免疫组化分析ERCC1表达的结果 |
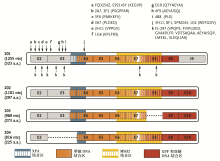
用除8F1和FL-297抗体外其余14种抗体标记的IHC绘制ERCC1抗原决定基的序列图,见 图2,免疫印迹法发现8F1、3H11、SPM243、1C6四种单克隆抗体均识别ERCC1蛋白中相同的区域,说明存在于这四种亚型蛋白中的这个区域能产生免疫作用。另外,16种抗体中没有1种抗体能特异地识别单一ERCC1亚型,每1种抗体至少识别3种不同的ERCC1蛋白亚型。
用定量RT-PCR分析不同肺癌细胞株和123例(IALT研究)手术切除的肿瘤样本中的ERCC1不同亚型mRNA表达,结果显示肿瘤中ERCC1不同亚型mRNA表达相对水平不同,根据肿瘤中ERCC1-202、ERCC1-204 mRNA水平进行生存分析,结果显示mRNA水平与OS( P=0.76)和无疾病进展生存均无相关性( P=0.33)。
用Western blot观察上述细胞株和肿瘤样本中ERCC1不同亚型蛋白表达水平,在这些样本中发现了ERCC1-202、ERCC1-203、ERCC1-204亚型蛋白表达,但是ERCC1-201亚型蛋白表达罕见,结果显示ERCC1亚型转录子和蛋白在细胞株和肿瘤标本中异质性表达。为了避免非功能性ERCC1蛋白过表达肿瘤的误分类,有必要鉴别各个亚型与铂-DNA加合物修复相关的功能。
通过敲除ERCC1基因获得Western blot无法观察到ERCC1蛋白表达但具有ERCC1基因染色体复制编码突变的7种A549克隆,发现和野生型母体A549细胞相比,这些缺乏ERCC1表达的克隆细胞中铂-DNA加合物提高了40%,暗示DNA剪切修复功能降低。另外,50%顺铂抑制浓度和野生型母体细胞相比降低了7倍,这些均确认了ERCC1在铂-DNA加合物修复和顺铂敏感性中的重要作用。
两种无ERCC1表达的克隆细胞(216、375)被转染只表达ERCC1其中一种亚型的慢病毒,从而产生ERCC1单个亚型表达的细胞,分别观察这些细胞的DNA修复功能,结果显示只有ERCC1-202亚型蛋白过表达才具有DNA剪切修复的功能意义。
目前使用不同ERCC1抗体标记的IHC仍不能特异性检测出单一的ERCC1功能亚型。因此,应用IHC观察ERCC1蛋白的表达还不能指导临床治疗。
对于接受手术切除治疗的ⅠB期、Ⅱ期或ⅢA期NSCLC患者,以铂类为基础的术后辅助化疗是现在的常规治疗手段,可以将NSCLC的5年生存率提高4%~5%[ 1]。然而铂类化疗耐药是铂类化疗过程中不可避免的问题,部分患者对铂类会产生原发性耐药或治疗早期耐药,从而影响辅助治疗减少复发转移的治疗效果。这其中肿瘤组织内的DNA损伤修复能力是影响铂类耐药的主要因素之一,碱基切除修复(base excision repair, BER)、核酸切除修复(nucleotide excision repair, NER)、错配修复(mismatch repair, MMR)、同源重组修复(homologous recombination repair, HRR)等众多DNA损伤修复通路的参与都可以影响DNA损伤修复能力。而NER通路被认为是与铂类耐药最为密切相关的[ 2]。
ERCC1是NER通路中的重要组成部分,和着色性干皮病相关基因F(xeroderma pigmentosum complementation group F, XPF)形成二聚体后可以在铂-DNA加合物附近进行剪切,随后通过NER修复方式去除铂类对DNA的破坏[ 3]。作为肿瘤疗效、预后等的可能生物标志物,对于ERCC1的研究近年来在不同层面都有深入的研究。包括基因组层面的多态研究[ 4, 5, 6],转录本层面的mRNA定量研究[ 7, 8],蛋白质层面的定性、定量研究等[ 9, 10, 11],研究都试图获得ERCC1与肺癌预后的直接或间接证据,进而挖掘ERCC1的定量定性检测在临床工作中的指导意义。在以往的众多研究中,多次证明肿瘤组织中的ERCC1表达水平对于顺铂为基础的术后辅助化疗具有预测疗效和预后的作用。
常用的ERCC1研究方法包括使用小鼠单克隆抗体8F1进行蛋白定量检测的免疫组化方法和使用RT-PCR方法进行的mRNA定量检测。而ERCC1具有四种剪切异构体(201-323aa、202-297aa、203-273aa、204-225aa),对于市售抗体是否能够特异性检测单一异构体以及异构体在DNA修复中的功能,并没有明确的研究报道。针对上述ERCC1研究中存在的问题,Friboulet等在一项肺癌术后顺铂辅助治疗的疗效评估研究中,使用8F1作为抗体对ERCC1进行免疫组化定量及Western blot定量,考察其作为疗效预测指标的可能性。此外使用15种市售抗体进行异构体的识别和功能性研究。
该研究的结果:
(1)494例验证标本中,ERCC1阳性的标本比例为78%,其中ERCC1阴性的患者,用药与否和OS无关。而ERCC1阳性的患者更倾向于受益于化疗;589例IALT标本在以前的试验中,ERCC1阳性率为44%,而本轮试验中的阳性率为77%。研究人员认为8F1的批号不同以及最新8F1的一些生物学性质的改变可能导致了如此悬殊的频率差异,同时也指出,一些最新的研究认为新的8F1有些非特异性的目标抗原出现,可能会影响ERCC1的检测准确性。本批数据中未能对之前ERCC1可以作为预后以及化疗疗效预测的生物标志物给出一致性的结论。
(2)8F1和市售的15种ERCC1抗体中,进行免疫组化检测时没有一个能够特异性识别单一异构体。都至少同时识别3个异构体,无法将异构体进行区分。
(3)在肺癌细胞系以及肺癌肿瘤组织中,ERCC1异构体的mRNA表达量与OS和无进展生存期无关。Western blot技术检测到在细胞系和肿瘤组织中,不同的异构体会同时表达,因此分辨具有修复功能的ERCC1异构体显得尤为重要。
(4)在7株ERCC1表达缺失的A549细胞系中,铂-DNA加合物含量都呈40%左右的增长,顺铂的IC50值都有50%的下降,意味着ERCC1缺失细胞对于顺铂的敏感性上升。
(5)在ERCC1缺失细胞株中,分别转入ERCC1-201、ERCC1-202、ERCC1-203、ERCC1-204异构体的慢病毒载体,仅ERCC1-202异构体能够显著增加细胞对顺铂的IC50,体系中的铂-DNA加合物也明显减少,提示ERCC1-202异构体为ERCC1参与NER通路的主要功能形式。
总体而言,该研究通过严谨的试验设计,完成了两个具有重要意义的工作。其一,通过比较不同批次的8F1抗体,指出不同批次的抗体可能是导致检测结果不一致的原因,同时也为众多对ERCC1研究没有能够得到统一的结果做出提示。其二,对于ERCC1基因4个不同的异构体通过mRNA定量,Western blot以及缺失/高表达细胞株的研究确认了ERCC1-202异构体为ERCC1在DNA损伤修复中主要的功能结构。为今后ERCC1在肿瘤研究中的进一步开展开拓了新的方向,同时提示了目前临床ERCC1作为预后和疗效预测生物标志物的不足,为ERCC1这一生物标志物的准确应用给出了新的提示。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|