|
刘晓晴,主任医师、教授,博士研究生导师,解放军第307医院全军肿瘤中心肺部肿瘤科主任。从事肿瘤临床治疗研究25年,目前主要研究方向为:肺癌的放疗、化疗及靶向生物综合治疗;肺癌个体化治疗的基础和临床研究。作为课题负责人多次承担首都医学发展基金、国家科技部重大专项、首都临床特色医疗、全军面上课题等研究。参与的研究工作获得军队医疗成果一等奖、二等奖3项,近5年以通讯作者(第一作者)在国内外专业期刊发表论文40余篇,参编著书7部。出色完成多项国际多中心和国内新药临床研究,获得明星研究团队和优秀研究者称号。目前担任中国抗癌协会化疗专业委员会委员,中国抗癌协会临床肿瘤学协作专业委员会小细胞肺癌专家委员会副主任委员,中国抗癌协会临床肿瘤专业委员会执委,中国女医师协会肿瘤专家委员会常委,全军放射肿瘤治疗学专业委员会委员,中国抗癌协会临床肿瘤学协作专业委员会肿瘤相关贫血专家委员会委员、肿瘤生物标志物专家委员会委员,中国老年肿瘤专业委员会肺癌分委会常委,卫生部合理用药专家委员会培训专家,《临床肿瘤学杂志》、《临床肿瘤学论坛》、《JTO中文版杂志》编委。 |
Tiseo M, Bordi P, Bortesi B, et al. ERCC1/BRCA1 expression and gene polymorphisms as prognostic and predictive factors in advanced NSCLC treated with or without Cisplatin[J]. Br J Cancer,2013,108(8):1695-1703.
1b。
FAST是一项研究晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)一线治疗情况的临床试验,拟解决以不含铂化疗替代含铂化疗方案的问题。同时检测了ERCC1/BRCA1表达和ERCC1/XPD/XRCC1-3单核苷酸多态性(single nucleotide polymorphism,SNP)对患者的预后和预测作用。
通过评估铂类的作用来研究 ERCC1/BRCA1免疫组化表达和 ERCC1 C8092A、 C118T、 XPD Lys751Gln、 XRCC1 Arg399Gln、 XRCC3 Thr241Met基因多态性对晚期NSCLC的预测作用。
•研究条件:意大利的前瞻性随机多中心临床试验(FAST临床试验)。
•研究起止时间:2001年10月至2006年6月。
•研究方法:(1)多中心多因素临床研究;(2)收集所有经治的NSCLC患者的组织学石蜡标本以评估ERCC1/BRCA1的免疫组化表达以及ERCC1 C8092A、 C118T、 XPD Lys751Gln、 XRCC1 Arg399Gln和XRCC3 Thr241Met基因多态性。
•研究对象:433例NSCLC患者。入组标准为:细胞学或组织病理学诊断的局部晚期或远处转移的NSCLC,年龄≥18岁,PS评分≤2分。
•干预措施:患者被随机分配到四个化疗组中的任一组:吉西他滨+顺铂(GP),吉西他滨+长春瑞滨(GN),吉西他滨+顺铂+异环磷酰胺(GIP)或吉西他滨+长春瑞滨+异环磷酰胺(GIN)。每3周进行一次化疗,最多化疗6个周期。
•评价指标:根据RECIST评价标准(1.0版)每3个周期做一次CT评价肿瘤疗效。评价指标为客观有效率(objective response rate, ORR)、无进展生存率(progression-free survival, PFS)、总生存率(overall survival,OS)。
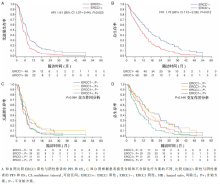
(1)ERCC1阴性患者比ERCC1阳性患者的ORR( P=0.004)、PFS( P=0.023)、OS( P=0.012)好,二者的差异有统计学意义,但是与治疗方案没有交互作用,见图1。
(2)BRCA1阳性患者比阴性患者生存时间更长,但是差异无统计学意义,与治疗方案也没有交互作用。
(3)在DNA修复基因多态性中,只有XRCC1 Gln/Gln 基因多态性具有潜在的预后作用( P=0.036)。
ERCC1的表达和XRCC1(Arg399Gln)基因多态性对接受一线化疗的晚期NSCLC患者有预后作用。但对顺铂的化疗疗效并无预测作用。
21世纪肿瘤治疗的临床医学特征之一就是个体化治疗,作为肺癌治疗手段中的传统化疗,希望突破疗效瓶颈,避免过度和有害治疗,只有通过个体化治疗才是实现上述目标的唯一途径。在分子靶向个体化治疗浪潮的推动下,我们看到化疗相关的研究也正在如火如荼地进行着。
既往的多项研究显示:DNA损伤修复基因ERCC1,不仅是生存预后指标,也可能预测含铂化疗方案的疗效。BRCA1对铂类和抗微管类药物的疗效显示出不同的影响。ERCC1、XPD、XRCC1、XRCC3的SNP显现出DNA修复能力的个体差异,也即在铂类化疗中可能有疗效和毒性预测作用[ 1, 2, 3, 4, 5, 6]。而遗憾的是由于研究大多为回顾性、小样本、单中心,其研究结果的可信度和说服力不强,指导临床还缺乏可靠的证据;此外各研究的设计方法、研究目标有异;选择的生物标志物检测方法不同,各中心的检测结果判断标准不一;再加之各研究涉及和观察的分子标志物反映肿瘤本质不同。总之多种因素让我们在众多可能不符或互为矛盾的结论中缺乏信心,或无所适从,却也欲罢不能。
为了进一步证实或明确ERCC1/BRCA1表达水平及ERCC1、XPD、XRCC1、XRCC3的SNP在铂类化疗中的预测作用及预后价值,意大利研究者在FAST研究基础上专门进行了BIO-FAST研究。FAST研究是在意大利进行的一项比较含铂/不含铂、两药/三药治疗初治ⅢB/Ⅳ期NSCLC的疗效和安全性的多中心、随机Ⅲ期临床试验。结果显示含铂化疗的PFS、OS均优于不含铂化疗,而三药方案并未优于两药方案[ 7]。生物标志物的研究(BIO-FAST)是在入组FAST研究的433例患者中,对其中110例获得肿瘤组织的患者进行生物标志物ERCC1和BRCA1免疫组化表达及ERCC1(C8092A、 C118T)、 XPD(Lys751Gln)、 XRCC1(Arg399Gln)、XRCC3(Thr241Met)的SNP检测。检测结果仅在含铂(GP和GIP)和不含铂(GN和GIN)两组间进行相关分析(并不行两药和三药间的比较)。研究结果显示,含铂组(57例)和不含铂组(53例)的化疗疗效和毒性与整组患者相似,且两组间差异无统计学意义。ERCC1免疫组化阴性组(48例)的ORR、PFS、OS均优于ERCC1阳性组(58例)( P<0.05); BRCA1免疫组化阴性组(53例)和阳性组(56例)的ORR、PFS、OS均相似( P>0.05)。进一步分析表明,无论是含铂或不含铂方案,ERCC1和BRCA1表达阳性或阴性均与其ORR、PFS、OS无显著相关性( P>0.05)。SNP的检测结果显示,除XRCC1(Arg399Gln)外,另3个基因的多态性在含铂和不含铂方案中与其患者的ORR、PFS、OS均无相关性( P>0.05)。结果说明ERCC1表达和XRCC1(Arg399Gln)是晚期NSCLC一线化疗的预后因素;而所有标志物均非NSCLC铂类化疗的预测因素。结论与以往的许多研究既有相同,也有相悖,实属情理中。
无论如何,BIO-FAST与既往类似生物标志物研究相比,此项研究设计和分析有其特点:
①针对与铂类药物相关的标志物,有目的地设计比较其对含铂和不含铂方案疗效和预后的影响。而此前大部分研究更多采用铂类化疗方案。
②在同一研究中,平行纳入含铂和不含铂方案,比较ERCC1和BRCA1表达水平不同患者的疗效更直接说明了标志物的预后作用(在未治疗组不能作为对照出现时)。
③进一步分析了在ERCC1和BRCA1表达水平不同的患者应用含铂和不含铂方案的疗效,这种交互检验的结果排除了可能影响预后的因素,更直接有力地说明了标志物对化疗的预测作用,设计可谓精巧、严谨,此对今后设计生物标志物研究有重要参考和指导意义。
④该研究结合免疫组化分析,同时进行了相关标志物SNP的研究也是一个亮点,但文中未对ERCC1表达与其多态性之间的关系进行深入探讨。对于阳性结果的标志物(SNP)可作为今后研究的重点。
该项研究不足之处:①回顾性研究。②虽然各组患者的临床特征相对平衡,但获得组织检测的患者偏少,可能导致选择偏倚,故结果的可信度受到质疑,这也是大部分关于生物标志物研究的不足之处。
鉴于上述两点,本研究的结论仍需慎待。
在未来我们应该着眼进行多中心、随机化、前瞻性的临床研究;并根据肿瘤发生、发展的规律和性质、所选择化疗药物的代谢组学特点,遴选最相关的多个分子标志物联合检测;规范和质控可能影响结果的检测方法和标准,相信不懈的努力终会让 “剪不断,理还乱”的个体化化疗现状走出尴尬困境。
后记:对本篇文章的点评刚即完稿,就从今年ASCO年会得到两项有关化疗生物标志物前瞻性研究均告失败的阴性结果[ 8, 9]。此必无疑会让本已迷雾重重的个体化化疗前景更加渺茫。症结哪里、真相何在?想必化疗相关生物标志物研究之路荆棘载途 、任重道远!
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|