| 熊建萍,女,主任医师、教授、博士研究生导师。现任南昌大学第一附属医院肿瘤科主任,南昌大学第一临床医学院肿瘤学教研室主任,江西省“555”工程赣鄱英才领军人才,江西省高校学科带头人。主持国家自然基金等科研课题多项,获江西省科技进步三等奖2项,南昌市科技进步二等奖1项,在国内外杂志发表论文50余篇,其中SCI收录论文7篇。任江西省抗癌协会肿瘤化疗专业委员会主任委员、中国医师协会肿瘤科分会委员、中国抗癌协会姑息和康复专业委员会常务委员、中国抗癌协会肿瘤化疗专业委员会委员、中国抗癌协会临床肿瘤学协作专业委员会(CSCO)执行委员、江西省抗癌协会副理事长、江西省医学会肿瘤专业委员会副主任委员。 |
Suwinski R, Klusek A, Tyszkiewicz T, et al. Gene expression from bronchoscopy obtained tumour samples as a predictor of outcome in advanced inoperable lung cancer[J]. PLoS One, 2012,7(7): e41379.
2a。
多个对早期手术治疗的非小细胞肺癌患者的研究表明,分子标志物对肺癌综合治疗有预后和预测的价值。但是这些研究主要是针对可手术治疗的早期患者,通过手术可获得高质量的肿瘤组织标本。许多肺癌患者在诊断时已是晚期,放疗和/或化疗是主要的治疗手段,并且病理诊断为小细胞肺癌的患者大部分不进行手术治疗。分子标志物应用于以放疗和/或化疗为主要治疗手段的肺癌患者的价值有待研究。
通过支气管镜检查取得肺癌患者的肿瘤组织标本,分析肿瘤组织多个mRNA标志物的表达与临床结果的相关性。
•研究条件:波兰格莱维茨放射治疗临床和教学医院。
•研究起止时间:2006年11月至2009年4月。
•研究方法:单中心前瞻性研究。
•研究对象:首次就诊时影像学诊断为晚期不可手术的肺恶性肿瘤,可经纤支镜检查获得肿瘤组织标本,病理确诊为肺癌的患者。
•干预措施:
研究入组不可手术且经纤支镜获取肿瘤组织标本、病理确诊为肺癌的患者112例。
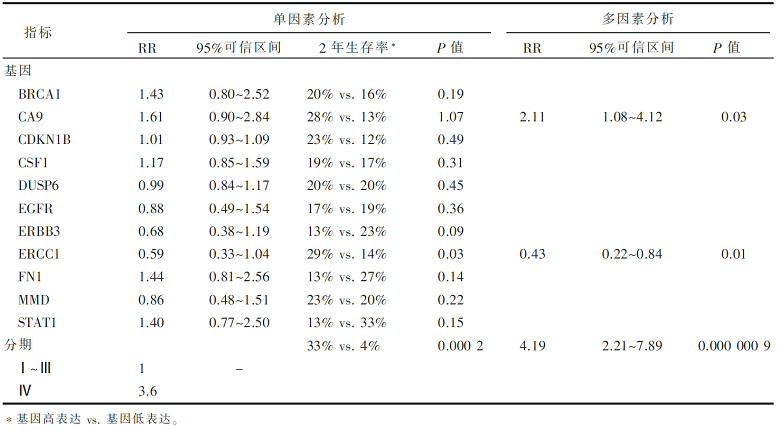
运用罗氏通用探针库、ABI 7900 HT实时定量PCR仪对肿瘤组织标本的基因进行分析,包括ERCC1、EGFR、BRCA1、CSF1、CA9、DUSP6、STAT1、ERBB3、MMD、FN1和CDKN1B共11个基因。
•评价指标:2年生存率,总生存时间(overall survival,OS),相对危险度(relative risk,RR)。
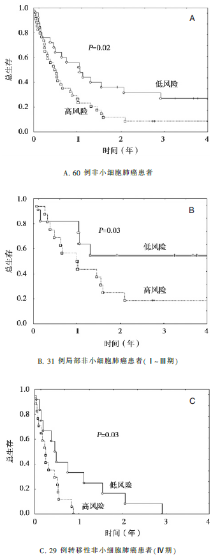
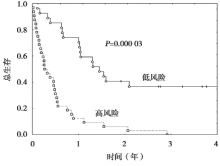
研究入组112例肺癌患者,60%的患者进行了以顺铂为基础的含铂双药化疗,57%的患者进行了总量20~70 Gy(中位为30 Gy)的放疗。在112例肿瘤组织标本中,82例(73%)提取获得大于50 ng(足够用于分析的量)的RNA,包括60例非小细胞肺癌标本,22例小细胞肺癌标本。辨别小细胞肺癌、鳞癌和腺癌的CDKN1B、CSF1和EGFR三个基因的最高科恩系数(k=0.177, P=0.004 1)。患者的基因表达和生存分析见 表1、 图1 和 图2。 图1中的5个基因表达指的是:CA9、FN1、STAT1的过表达标记为+1,ERCC1 或 ERBB3的过表达标记为 -1,总分≥0表示高风险。 图2中基于多因素分析的风险分数R=(4.19×分期)+(2.11×CA9)-(0.42×ERCC1),大于2.5表示高风险。
| 表1 60例非小细胞肺癌的基因表达和分期的生存分析 |
以化疗和放疗为治疗手段的晚期肺癌,纤支镜获得肿瘤组织标本进行多个基因表达分析作为预后标志物是可行。但是获得高质量、足够量的RNA标本以进行基因分析是一个限制性因素。
一直以来,我们主要通过TNM分期来判断肺癌患者的预后。然而,同一分期的患者的生存也会有巨大差异,TNM分期对此难以作出解释。于是人们通过研究基因来帮助判断预后,从单一基因分析发展到目前采用基因芯片技术等筛选肺癌预后相关基因。
本研究入组影像学诊断为晚期肺癌的患者,通过纤支镜检查获取标本,一方面进行病理诊断,另一方面通过实时定量PCR分析患者的一些基因表达情况。研究者通过多因素分析探讨临床因素及基因表达程度与患者生存的关系,试图构建晚期肺癌患者的预后模型。主要研究结果来自于对60例非小细胞肺癌的基因分析,提示CA9、ERCC1及肿瘤分期是独立的预后因素,并给出一个计算风险评分的公式:风险评分=(4.19×分期)+(2.11×CA9)-(0.42×ERCC1),评分超过2.5为高风险。
目前,大多数基因分析研究都在早期肺癌术后患者中进行。比如发表在2004年《J Clin Oncol》杂志的8基因检测(PTK7、CIT、SCNN1A、PGES、ERO1L、ZWINT及两个ESTs)[ 1],2007年《N Engl J Med》杂志的5基因检测(DUSP6、MMD、STAT1、ERBB3和LCK)[ 2],还有我国学者发表在2010年《J Clin Oncol》杂志针对ⅠB期肺癌术后患者构建的预测模型[ 3]。这些研究的目的是希望区分出复发的高危或低危患者,进而确定哪些人群需要术后辅助治疗或是选择何种治疗方法,较早开展的有乳腺癌的21-基因复发评分评估。而目前临床上已经成功应用的有Ⅱ期结直肠癌患者MMR检测,指南认为dMMR的患者无需接受氟尿嘧啶类药物的术后辅助化疗。
本研究入组的患者是在基线评估为不可手术的晚期患者,综合了临床因素及基因表达特征分析,得到了一个明确的结论。但是由于样本量少,因此所纳入分析的因素也有限,仅选择了6个临床因素和11个兴趣基因。我们知道,如果研究中纳入更多不同的基因,极可能会得出不同的结论。而且,作者参考的基因来自于早期肺癌术后患者的研究。早期患者与晚期患者有一定的区别,这种区别可能就存在于某些基因中。或许,某些基因的低表达很可能使得患者长时间处于一个疾病的早期阶段,而另一些基因的高表达会让患者很快进入疾病晚期。
其次,我们知道,同为非小细胞肺癌,肺腺癌和鳞癌是两个区别很大的疾病。这两个疾病的驱动基因也相差甚远,这就导致我们的治疗方法也不一样。比如腺癌患者出现EGFR基因突变的比例明显高于鳞癌患者,因此我们可以使用EGFR-TKI治疗多数肺腺癌患者。本研究将肺腺癌和鳞癌患者放在一起分析值得商榷。而且,该文中也发现BRCA1、CDKN1B、ERCC1的表达在肺腺癌及鳞癌中有不同的趋势,但差异无统计学意义,可能是样本量太小。该研究含60例非小细胞肺癌,其中鳞癌38例,腺癌12例,不明确型10例,鳞癌例数显著多于腺癌患者,原因是该研究全部采用纤支镜活检获得病理,通常中央型患者才能取到,而中央型的患者多数为鳞癌。目前临床实践中,肺腺癌患者明显增多,而该研究结论主要来自鳞癌患者,因此我们能否直接拿来套用,仍需进一步检验。研究表明,影响肺腺癌和鳞癌患者预后的表达基因也不相同[ 4, 5, 6, 7]。此外,本研究未进行二阶段的独立验证,欠说服力。即使验证成功,仍需在实践中反复检验。比如杜克大学的一项研究结果曾发表于的2006年《N Engl J Med》杂志[ 7],研究者通过基因芯片方法建立了一个肺荟萃基因模型(lung metagene model),能够判断早期肺癌术后患者的预后。然而,作者在2011年要求撤回该文,原因是使用该模型无法重复之前的结果。
本研究中的标本均为纤支镜下所取,相比于患者手术后的标本,其量难免偏少,这也就导致该研究中30/112例标本未能进行RT-PCR分析,丢失了较多的样本量。如何进一步优化,实现更少标本量就能够进行基因分析,也是值得研究的问题。对于某些基因的表达,究竟是使用免疫组化好还是RT-PCR好尚未明确。尤其是生物标志物的定量标准,到底多少是为高表达或低表达尚未定论。而且不同研究中心使用的基因芯片及数据分析方法不同,这些都会导致研究结果难以重复。
必须承认,通过基因表达特征构建肺癌患者预后模型的前景是光明的,但目前尚不成熟。值得一提的是,在治疗晚期恶性肿瘤患者过程中,与患者的预后相比,我们或许更关注何种治疗或药物的疗效与基因表达特征相关。如果做到这一点,即使面临预后差的患者,同样能够通过恰当的治疗为其带来生存获益和生活质量的改善,这也是我们一直努力探索的方向。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|