作者简介: 王妍(1982-),女,江苏如皋人,主治医师,医学硕士,从事消化道肿瘤的化疗及姑息治疗。
目的比较重组人血小板生成素及重组人白细胞介素-11临床应用的疗效和安全性。方法通过计算机检索中国生物医学文献数据库(1979年至2012年7月)、万方数据资源系统(1977年至2012年7月)、中国科技期刊数据库(1989年至2012年7月)和中国知网(1999年至2012年7月),纳入重组人血小板生成素临床应用的所有平行对照试验。结果最后共7篇文章进入本系统综述。与重组人白细胞介素-11相比,重组人血小板生成素可改善血小板最低值[加权均数差1.76,95%可信区间(0.08,3.43),
Objective To investigate whether recombinant human thrombopoietin(rhTPO) is better than recombinant human interleukin-11 (rhIL-11).Methods Meta-analysis was conducted with all the qualified clinical randomized trials which compared rhTPO with rhIL-11 in chemotherapy induced thrombocytopenia (CIT). Database includes CBM disc, Wanfang data resource, China Science and Technology Periodical Database and CNKI, and the censor data was up to July 2012. All the calculations and statistical tests were done with the RevMan 5 software.Results Finally, 7 trials achieved all the criteria. Compared with rhIL-11, rhTPO can further improve the minimum value of blood platelet [WMD 1.76, 95%CI(0.08, 3.43),
肿瘤化疗所致血小板减少症(chemotherapy induced thrombocytopenia,CIT)是指肿瘤化疗药物对骨髓产生抑制作用尤其是对巨核细胞产生抑制和杀伤作用导致的外周血中血小板计数低于100×109/L的临床情况[ 1],是临床常见的化疗药物剂量限制性毒性反应,常迫使临床医生降低化疗药物剂量或延迟化疗,甚至终止化疗,这些都可能影响临床疗效和患者生存,增加医疗支出[ 2]。
目前国内对CIT常用的处理办法包括输注血小板、使用血小板生长因子等。输注血小板可能会引起输血相关性病毒和细菌感染,反复多次输注血小板产生抗体导致的异体免疫反应等问题也日益突出,血源紧张也限制了血小板的临床应用。近年的研究表明,使用血小板生长因子能够有效升高血小板,降低出血风险,减少血小板输注,保证化疗如期足量进行。
目前只有重组人促血小板生成素 (recombinant human thrombopoietin, rhTPO)和重组人白细胞介素-11(recombinant human interleukin-11,rhIL-11)被我国食品药品监督管理局批准用于此适应证。血小板生成素是高特异性的血小板刺激因子,直接作用于骨髓造血干细胞,对巨核细胞生成的各阶段均有刺激作用,调控血小板生成的各个阶段,特异性升高血小板[ 3]。白细胞介素-11(interleukin-11,IL-11)由人类骨髓基质细胞(成纤维细胞)及间质细胞分泌产生,1990年,Paul等[ 4]首先在灵长类骨髓基质永生细胞系Pu-34中发现IL-11可以促进血细胞生长。随后,动物实验证实[ 5]:小鼠和非人灵长类动物中,IL-11可以使外周血小板数目增多,同时使网织红细胞和白细胞数目增加。这两种血小板生长因子在治疗CIT中究竟孰优孰劣,相关研究结论并不一致。且由于试验设计的问题,很多研究的病例数较少,缺乏代表性。因此,应用循证医学方法,对两种血小板生长因子的临床应用情况进行科学、客观的评价就显得更加重要。本文通过荟萃分析方法,对rhTPO及rhIL-11的临床疗效和安全性进行系统评价。
研究设计为国内1950年至2012年7月已发表的所有平行对照试验,比较rhTPO和rhIL-11两种治疗方法,语种限于中文。研究对象为恶性肿瘤患者,临床诊断为CIT。治疗措施的剂量、疗程、给药途径等均不受限制。疗效指标为化疗后血小板最低值、化疗后血小板最高值、化疗后血小板≤50×109/L的持续时间、化疗后血小板恢复至≥75×109/L的时间、化疗后血小板恢复至100×109/L的时间、血小板输注比例。安全性指标为两组药物不良反应发生率。
资料来源:中国生物医学文献数据库(1979年至2012年7月)、万方数据资源系统(1977年至2012年7月)、中国科技期刊数据库(1989年至2012年7月)和中国知网(1999年至2012年7月)。检索词:重组人血小板生成素。
纳入的随机对照试验的方法质量采用Cochrane Reviewer Handbook 4.2.3 随机对照研究标准进行评价,对每个研究的质量评价包括如下内容:①是否详细描述随机方法,随机方法是否正确;②是否报告了分配隐藏的情况;③是否采用盲法;④是否报告了失访及退出的情况;⑤是否进行基线一致的比较。根据文献纳入标准分为A、B、C三级,若基本满足以上5条质量标准,发生各种偏倚的可能性最小,为A级;部分满足以上质量标准者,发生偏倚可能性为中度,为B级;几乎完全不满足以上质量标准者发生偏倚的可能性为高度,为C级。由两名研究者分别独立对研究质量进行评价,意见不一致时,请第三名研究者协助评价。
统计分析采用Cochrane协作网提供的RevMan 5软件[ 6]。采用χ2检验分析各研究间的统计学异质性,以 P=0.10为检验水平。无统计学异质性研究结果的合并分析选择固定效应模型。反之,可认为多个研究有异质性,此时,可使用敏感性分析或分层分析等异质性处理方法使之达到同质后,再使用固定效应模型。若经异质性分析和处理后,多个独立研究的结果仍然不具有同质性时,可选择随机效应模型计算其合并统计量。计量资料采用加权均数差(weighted mean difference, WMD)表示,计数资料采用相对危险度(relative risk,RR)表示,区间估计均采用95%可信区间(confidence interval,CI)。潜在的发表偏倚采用“漏斗图”进行分析。
通过计算机查找关键词检索出文章409篇:中国生物医学文献数据库检出文献45篇,万方数据资源系统检出文献193篇,中国科技期刊数据库检出文献74篇,中国知网检出文献97篇。在仔细阅读题目及摘要后,初步排除不符合本系统评价研究目的文献386篇,获得可能符合纳入标准文献23篇。仔细阅读全文后,4篇为自身对照研究而被排除,6篇文献无对照组而被排除,6篇文献为安慰剂对照研究而被排除。最后共7篇文献进入本系统评价[ 7, 8, 9, 10, 11, 12, 13]。
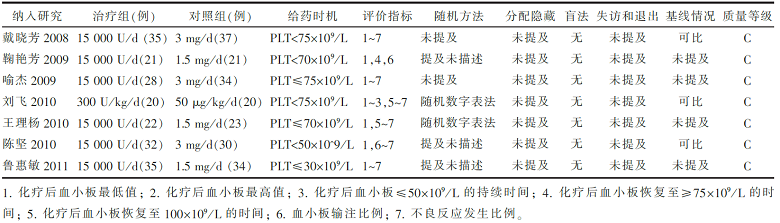
纳入研究发表于2008-2011年,样本量最大72例,最小40例,见 表1。纳入研究治疗组采用的药物均为国产rhTPO(商品名特比澳,沈阳三生股份有限公司)。纳入研究均每日给药:(1)血小板值从化疗后下降的最低值开始计算,至其绝对值升高≥50×109/L; (2)血小板值从化疗后下降的最低值升高到≥100×109/L停药。除1项研究外,其余所有研究均采用随机方法,但仅2项研究阐述具体方法,均未提及分配隐藏,未采用盲法。共3项研究进行了基线一致性的比较,并进行可比性试验。
| 表1 纳入研究的特征及质量评价 |
2.3.1 化疗后血小板最低值
共7项研究比较了化疗后rhTPO组和rhIL-11组血小板的最低值,见 图1。治疗组共193名患者,对照组共199名患者。荟萃分析的结果提示两组间差异有统计学意义[WMD 1.76,95%CI(0.08,3.43), P=0.04]。与rhIL-11相比,rhTPO可改善血小板最低值。
2.3.2 化疗后血小板最高值
共4项研究比较了化疗后rhTPO组和rhIL-11组血小板的最高值,见 图2。治疗组共120名患者,对照组共127名患者。荟萃分析的结果提示两组间差异有统计学意义[WMD 74.87,95%CI(52.54,97.20), P<0.000 01]。与rhIL-11相比,rhTPO显著升高血小板最高值。
2.3.3 化疗后血小板≤50×109/L的持续时间
共4项研究比较了化疗后rhTPO组和rhIL-11组血小板≤50×109/L的持续时间。治疗组共118名患者,对照组共125名患者,荟萃分析的结果提示两组间差异有统计学意义[WMD -1.61,95%CI(-2.03,-1.19), P<0.000 01]。与rhIL-11相比,rhTPO显著缩短血小板≤50×109/L的持续时间。
2.3.4 化疗后血小板恢复至≥75×109/L的时间
共4项研究比较了化疗后rhTPO组和rhIL-11组血小板恢复至≥75×109/L的时间。治疗组共119名患者,对照组共126名患者,荟萃分析的结果提示两组间差异有统计学意义[WMD -3.74,95%CI(-4.29,-3.19), P<0.000 01]。与rhIL-11相比,rhTPO显著缩短血小板恢复至≥75×109/L的时间。
2.3.5 化疗后血小板恢复至100×109/L的时间
共5项研究比较了化疗后rhTPO组和rhIL-11组血小板恢复至100×109/L的时间。治疗组共140名患者,对照组共148名患者,荟萃分析的结果提示两组间差异有统计学意义[WMD -3.35,95%CI(-4.27,-2.42), P<0.000 01]。与rhIL-11相比,rhTPO显著缩短血小板恢复至100×109/L的时间。
2.3.6 血小板输注比例
共7项研究比较了化疗后rhTPO组和rhIL-11组血小板的输注比例。治疗组共193名患者,对照组共199名患者,荟萃分析的结果提示两组间差异有统计学意义[RR 0.39,95%CI(0.23,0.66), P=0.000 5]。与rhIL-11相比,rhTPO显著减少了血小板的输注比例。
2.3.7 不良反应发生率
共6项研究比较了化疗后rhTPO组和rhIL-11组不良反应发生率。治疗组共172名患者,对照组共178名患者,荟萃分析的结果提示两组间差异有统计学意义[RR 0.20,95%CI(0.13,0.31), P<0.000 03]。与 rhIL-11相比,rhTPO不良反应发生率低。
抽出研究样本量最大的1篇化疗后血小板最低值的疗效分析的文章, 其余各研究的荟萃分析结果提示两组间差异仍有统计学意义[WMD 1.87,95%CI(0.16,3.57), P=0.03]。去除样本量最大的文献后,荟萃分析的结果与原先结果无差异。
用化疗后血小板最低值的疗效分析结果指标进行回归分析表明,图形分布对称,表明结果不存在发表偏倚。
近年来,随着铂类、吉西他滨等化疗药与其它抗肿瘤药物联合应用的增多,在疗效提高的同时,CIT的发病率也更高。发生CIT后,除输注血小板外,目前只有rhTPO和rhIL-11被我国食品药品监督管理局批准用于此适应证。目前已有临床试验对这两种血小板生长因子的疗效、副反应、适应证等方面进行评价,但各研究间存在异质性,目前并无一致结论,且大部分研究的样本量较小,不能提供足够的检验效能。本荟萃分析显示,rhTPO在改善血小板最低值、提高血小板最高值、缩短血小板≤50×109/L的持续时间、缩短血小板恢复至≥75×109/L及恢复至≥100×109/L的时间方面均优于rhIL-11,且输注比例及不良反应发生率更低。敏感性分析前后结论一致,化疗后血小板最低值结果的稳定性较好。漏斗图显示结果不存在发表偏倚。
本荟萃分析中,纳入研究的给药时机相差甚远,给药剂量也不一致。其中3项研究从血小板低于75×109/L开始给药,2项研究从血小板低于70×109/L开始给药,1项研究从血小板低于50×109/L、1项研究从血小板低于30×109/L才给药。rhTPO给药剂量均为15 000 U/L,而rhIL-11的给药剂量为1.5~3 mg。纳入研究治疗标准的不一致可能会导致各研究结果间存在临床异质性,会在一定程度上影响结果,从而可能会影响结论。
本荟萃分析纳入的7项研究的方法学存在诸多缺陷:(1)仅2项研究提及具体随机方法,所有研究均未采用盲法及分配隐藏;(2)所有研究均未描述失访及退出的情况;(3)未进行样本含量的估算,大部分样本量较小;(4)4项研究未具体描述基线是否可比。由于纳入研究的总体研究质量偏低,从而影响最终结论的可靠性,需谨慎对待上述研究结果。国内临床研究总体质量不尽如人意,这也需要我们在日后的研究中修正研究设计的缺陷,提高我国的文献水平。
目前rhTPO及rhIL-11这两种血小板生长因子正广泛应用于临床。尽管本荟萃分析的数据表明rhTPO的临床疗效更优,但数据应用仍需谨慎行事,期待日后更多设计良好的大型随机对照临床试验证实本结果。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|