作者简介: 陈艳丽(1981-),女,湖南衡阳人,主治医师,医学硕士,研究方向为妇科肿瘤。
目的评价新辅助化疗治疗局部晚期宫颈癌的临床疗效。方法电子检索Cochrane 图书馆、MEDLINE、EMBASE、PubMed、CBMdisc数据库,收集符合纳入标准的文献,提取资料、评价纳入研究的方法学质量,并提取有效数据进行Meta分析。结果符合纳入标准共5篇文章,4篇为前瞻性随机对照试验,1篇为回顾性病例对照研究。新辅助化疗对局部晚期宫颈癌的5年生存率没有影响(相对危险度1.07,95%可信区间0.88~1.29,
Objective To evaluate the clinical efficacy of neoadjuvant chemotherapy (NACT) and radical surgery(RS) in locally advanced cervical cancer.Methods The following electronic databases were searched: CBMdisc,MEDLNE, PubMed, EMBASE, Cochrane Library. All eligible documents were assessed for quality, and extracted data were performed by a meta-analysis.Results 5 articles met the inclusion criteria, among which were four prospective randomized controlled trials and one retrospective case-control study. NACT and RS did not increase the 5-year survival rate, but increased the 5-year disease-free survival rate and decreased lymph node metastasis and parameter metastasis.Conclusion NACT and RS could be chosen to treat the locally advanced cervical cancer. It increased the 5-year disease-free survival rate and decreased lymph node metastasis and parameter metastasis. But the conclusion is needed to be further assessed by rigorously designed, randomized, double-blind, controlled trials.
局部晚期宫颈癌(locally advanced cervical cancer, LACC)是一组具有不良预后因素的高危宫颈癌,广义为ⅠB2~ⅣA期,按2009年国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)的分期,为Ⅰ B 2~ ⅡA期宫颈癌[ 1, 2]。LACC的突出特点是肿瘤体积大和间质浸润深,盆腔淋巴结转移率高达35%~80%,仅行手术者的复发率高(近30%),且术后近90%的患者需要补充治疗,导致治疗相关死亡率和并发症增加[ 3]。因此,国内外学者对宫颈癌的化疗进行了较深入的研究,提出并开展了宫颈癌的新辅助化疗(neoadjuvant chemotherapy,NACT),以期提高手术切除率和放疗的敏感性,改善患者的预后。NACT是指对宫颈局部晚期的患者,在手术或放疗前,先行化疗。自1982年Frei提出并开始首例宫颈癌NACT以来[ 4],许多学者对此进行了临床研究,认为NACT对局部晚期宫颈癌有良好的疗效。但有一部分研究者的结果却提示NACT对局部晚期宫颈癌患者的预后无改善作用,NACT的毒副反应反而增加了患者的痛苦,并且增加了患者的治疗成本,给患者的经济及生活质量带来不良影响。因此我们对NACT治疗局部晚期宫颈癌的疗效进行循证医学评价,以期为临床决策的选择提供科学依据。
1.1.1 研究对象
所有经病理证实为LACC(ⅠB2~ⅣA期)并以手术治疗为主的患者,手术方式为根治性子宫切除+盆腔淋巴结切除/取样术。采用FIGO临床分期的患者。不受患者年龄、种族的限制。
1.1.2 研究类型
临床随机对照试验(randomized controlled trial, RCT)、前瞻性非随机对照试验(prospective non-randomized controlled trial)、回顾性临床对照研究。
1.1.3 干预措施
试验组:NACT+根治性全子宫切除+盆腔淋巴结切除/取样。
对照组:根治性全子宫切除+盆腔淋巴结切除/取样。
1.1.4 疗效判定指标
主要指标:局部复发率、远处复发率、总体复发率、总体生存率、无瘤生存率、宫旁浸润率、淋巴结阳性率。
次要指标:术后并发症发生率、术中并发症发生率。
排除复发性子宫颈癌患者;排除文献内容不是直接比较NACT+根治性全子宫切除术与根治性全子宫切除术的结果。
1.3.1 检索的数据库
外文数据库: PubMed、 EMBASE、 MEDLINE、Cochrane图书馆妇科肿瘤专业数据库和循证医学数据库(evidence-based medicine reviews,EBMR)。
中文数据库:中国生物医学文献数据库、维普科技期刊数据库、清华同方数据库。
1.3.2 检索词
英文:neoadjuvant chemotherapy、 cervix/cervical cancer/carcinoma、local advanced。
中文:宫颈癌、新辅助化疗、局部晚期、根治性子宫切除。
1.3.3 检索时间期限
1995-2009年发表的文献。
各临床试验的方法学质量评价由两位研究者独立完成,若有分歧采用讨论的方式解决。研究的方法学质量评价采用Jadad量表进行评价。评分为1~3分视为低质量,4~7分视为高质量。
•随机序列的产生
恰当:计算机产生的随机数字或类似方法(2分),不清楚:随机试验但未描述随机分配的方法(1分),不恰当:采用交替分配的方法如单双号(0分)。
•随机化隐藏
恰当:中心或药房控制分配方案或用序列编号一致的容器、现场计算机控制、密封不透光的信封或其他使临床医生和受试者无法预知分配序列的方法(2分),不清楚:只表明使用随机数字表或其他随机分配方案(1分),不恰当:交替分配、病例号、星期日数、开放式随机号码表、系列编码信封以及任何不能防止分组的可预测性的措施(0分),
未使用(0分)。
•盲法
恰当:采用了完全一致的安慰剂或类似方法(2分),不清楚:试验陈述为盲法,但未描述方法(1分),不恰当:未采用双盲或盲法不恰当,如片剂和注射剂比较(0分)。
•撤出与退出
描述了撤出或退出的数目和理由(1分), 未描述撤出或退出的数目或理由(0分)。
按照设计好的表格提取资料,对符合纳入标准的试验提取资料并填写表格,缺乏的资料通过与临床试验的负责人联系予以补充。
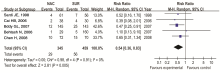
采用Cochrane协作网提供的RevMan 5.0统计软件做Meta分析。计数资料采用相对危险度(relative risk,RR)为疗效分析效应量并计算其95%可信区间(confidence interval,CI),计量资料采用加权均数差(weight mean difference,WMD)作为效应量并计算其95%CI。采用χ2检验分析各研究间的异质性,当各研究间无统计学异质性( P>0.1, I2≤50%),采用固定效应模型对各研究进行Meta分析;如研究间存在统计学异质性( P≤0.1, I2>50%),采用随机效应模型分析,并进行亚组分析,谨慎解释研究结果。
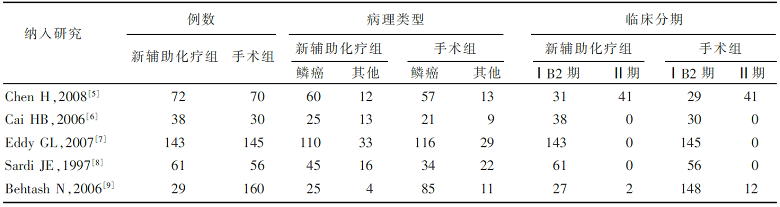
初检获得1 135篇相关文献,剔除重复发表和交叉的文献、明显不符合纳入标准的文献后,剩下320篇文献,经阅读文章摘要及全文后纳入5篇文献,4篇是RCT,1篇是回顾性病例对照研究。纳入研究的基本特征见 表1。
| 表1 纳入研究的一般情况 |
2.3.1 疗效判定 疗效评价的指标包括局部复发率、远处复发率、总体复发率、总体生存率、无瘤生存率。纳入的5个研究都是治疗结束后进行疗效评价。5个研究均报道了总体生存率、无瘤生存率、淋巴结转移率、宫旁浸润率。
2.3.2 不良反应 术后并发症的发生率,Chen[ 5]报道了两组术后并发症的发生率(手术组21.2% vs. 新辅助化疗组25.7%, P=0.626),两者差异无统计学意义。其他纳入的文献未报道术中并发症的发生率。
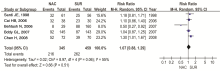
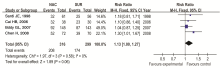
2.4.1 5年生存率比较分析 纳入5个研究,各研究之间有异质性,采用随机效应模型进行Meta分析,合并量的RR=1.07(95%CI 0.88~1.29), P=0.51,NACT组与手术组的5年生存率差异无统计学意义,见 图1。剔除研究质量较低的研究进行敏感性分析,见 图2。
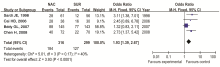
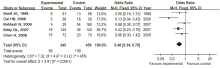
2.4.2 5年无瘤生存率比较分析 纳入5个研究,各研究之间有异质性,采用随机效应模型进行Meta分析,合并量的RR=1.84(95%CI 1.13~2.99), P=0.01, NACT组与手术组的5年无瘤生存率差异有统计学意义,NACT组的5年无瘤生存率高,见 图3。剔除研究质量较低的研究进行敏感性分析,见 图4。
2.4.3 淋巴结转移率比较分析 纳入5个研究,各研究之间无异质性,采用固定效应模型进行Meta分析,合并量的RR=0.48(95%CI 0.34~0.7), P<0.000 1,NACT组与手术组的淋巴结转移率差异有统计学意义,NACT组的淋巴结转移率低,见 图5。
2.4.4 宫旁转移率比较分析 纳入5个研究,各研究之间有异质性,采用随机效应模型进行Meta分析,合并量的RR=0.54(95%CI 0.36~0.83), P=0.005,NACT组与手术组的宫旁转移率差异有统计学意义,NACT组的宫旁转移率低,见 图6。
此次Meta分析的结果认为,NACT对LACC患者的5年生存率无改善,但降低了术后淋巴结转移率、宫旁浸润率,并改善患者的5年无瘤生存率。
由于本研究中纳入的文献使用的研究方法不一致,而且全为已经发表的期刊文献,缺乏未发表的资料、政府研究报告和其他非传统文献来源的证据,因此可能会漏掉阴性结果的研究而产生发表偏倚。因为纳入的文献只有部分为RCT,且随机分配方案隐藏方法不明确,因此可能产生选择、实施和结果测量偏倚。从而影响了结果及其论证强度。纳入研究的评分较低,主要是隐藏盲法缺失(化疗或者手术治疗均需要患者签字同意,无法做到患者、干预者双盲)。
NACT延长了LACC患者的无瘤生存时间,降低了患者术后淋巴结转移率及宫旁浸润率。理论上讲降低了患者术后接受辅助性放化疗的机会,从而有利于提高患者术后的生活质量。但是目前还无相关生活质量调查的随机双盲对照研究的数据报道。综上所述,因本研究纳入的为小样本研究,且文献的质量不高,因此该研究得出的结果需要谨慎对待,仍需要多中心大型的RCT结果来验证该研究的结果。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|