作者简介: 邓尚新(1980-),男,南宁人,医学博士,主要从事消化道疾病的早期诊治研究。
目的针对慢性胰腺炎随访中新发糖尿病的患者,展开最佳治疗证据的检索,指导胰源性糖尿病的治疗。方法计算机检索MEDLINE、EMBASE、Cochrane 图书馆、CBMdisc、万方数据库和中国知网数据库,寻找胰源性糖尿病的治疗指南、系统评价、临床研究、文献综述等证据,并对所获证据进行分析评价。结果目前尚无胰源性糖尿病的诊治指南,胰源性糖尿病的治疗目标与其他类型糖尿病一致,治疗方法包括基础营养治疗、口服降糖药物和强化胰岛素治疗。降糖药物与胰岛素运用上存在一定分歧,强化胰岛素可能增加了发生胰腺癌的风险,而二甲双胍降低了这种可能性。结论胰源性糖尿病的治疗需采取综合措施,强调患者对血糖监测的依从性,避免严重低血糖的发生,同时做好早期胰腺肿瘤的检测。
Objective To formulate an individualized evidence-based treatment for a chronic pancreatitis patient with new onset diabetes.Methods We attempted to get the evidences of treatments in pancreatic diabetes, which induced by chronic pancreatitis, by searching MEDLINE, EMBASE, Cochrane library, CBM disc, Wanfang data and CNKI. The evidences were collected and critically assessed after the clinical issues were put forward.Results No clinical guideline was available for the treatment of pancreatic diabetes. With the same purpose of treatment in other types of diabetes, treatments of pancreatic diabetes included basic nutrition therapy, oral agencies for blood glucose control and intensive insulin therapy. Discussions of the use of antidiabetic drugs and insulin were ongoing, and different opinions were detected. Insulin might increase the risk of pancreatic cancer, while metformin reduced this possibility.Conclusion Comprehensive measures should be taken in the management of pancreatic diabetes. Intensive insulin therapy should be applied to patients with high compliance, and avoid the occurrence of severe hypoglycemia. Meanwhile, early tumor detection should be especially noticed with pancreatic diabetes.
患者,男性,43岁,以“慢性胰腺炎1年,查体血糖增高1天”收治入院。患者2011年2月于兰州总医院消化内科经上腹部增强CT、磁共振逆行胰胆管造影、超声内镜确诊为慢性胰腺炎(chronic pancreatitis,CP),当时空腹、餐后2小时血糖及糖化血红蛋白(hemoglobin A1c,HbA1c)均正常,CEA、AFP、CA19-9未见异常。出院后纳入CP随访计划,院外行胰酶替代等治疗。入院前患者空腹血糖7.6 mmol/L,HbA1c 7.2%,门诊遂以“慢性胰腺炎,胰源性糖尿病”收治入院。查体:生命体征平稳,神志清楚,皮肤、巩膜无黄染,浅表淋巴结未扪及肿大,心肺无异常,腹部平软,中上腹轻压痛,无反跳痛,肝脾肋下未触及,肝肾区无叩击痛,肠鸣音4次/分。与前次入院相比,患者体重增加约2 kg。体重指数19.5 kg/m2。复查空腹血糖7.9 mmol/L,餐后2小时血糖11.8 mmol/L,HbA1c 7.2%,CEA、AFP、CA19-9正常。胰腺薄层CT显示:胰腺体积萎缩,钙化,未见肿瘤性病变。
依据CP诊治指南[ 1],患者CP诊断明确。我科CP随访计划旨在帮助患者实现肿瘤早期诊断。由于CP和新发糖尿病(new onset diabetes)是胰腺癌(pancreatic cancer,PC)发生发展的两个重要因素[ 2],患者查出“血糖增高”后即被要求入院检查和治疗。
依据美国糖尿病学会(American Diabetes Association, ADA)及国内糖尿病防治指南[ 3, 4],确认排除胰腺肿瘤,患者被诊断为罹患糖尿病。与传统糖尿病(1型和2型,T1DM和T2DM)不同,此患者系因胰腺实质进行性纤维化、钙化,而影响胰腺内、外分泌功能,导致胰腺分泌的激素紊乱,临床上最终表现为糖耐量异常或显性糖尿病。根据ADA对糖尿病的最新分类方法,胰腺外分泌疾病(如胰腺炎、创伤、感染、胰腺切除、胰腺肿瘤等)引起的糖尿病归类为特殊类型的糖尿病,即属第三类糖尿病(type 3c diabetes,T3cDM)。
西方国家的流行病学研究提示,T3cDM占所有糖尿病患者的5%~10%,而75%的T3cDM系由CP引起[ 5];CP与T3cDM关系十分密切,但目前国内的文献报道仍较少。CP本身具有着较高的癌变潜质,而此现象多发生于新发糖尿病2年内的CP患者[ 2];因此发生T3cDM的CP患者应是早期防治PC的重点对象[ 6]。为此,我们提出以下临床问题:①CP引起的T3cDM的治疗目标是什么,是否与T1DM或T2DM一致?②该采取怎样的治疗方法?③不同控糖药物的利弊如何?④血糖控制治疗对CP癌变有无影响?
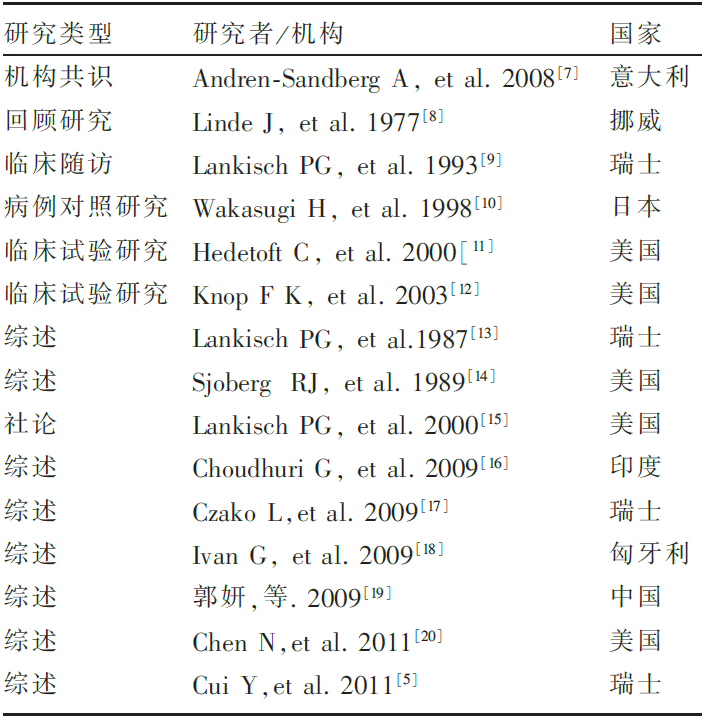
计算机检索MEDLINE、EMBASE、Cochrane 图书馆、CBMdisc、万方数据库、中国知网数据库。检索范围从数据库建库至2012年3月。主题词包括:胰源性糖尿病(pancreatic diabetes、 pancreatogenic diabetes、 pancreatic diabetes mellitus、 diabetes mellitus secondary to chronic pancreatitis), 治疗或管理(treatment、 management、 therapy、 therapeutic approach),荟萃分析(meta-analysis、 systematic review),指南(clinical guideline),随机对照研究(randomized control trial),队列研究(cohort study)和综述(review)。从中筛选出与胰源性糖尿病治疗密切相关的临床指南、Meta 分析/系统评价、随机对照试验(randomized control trial,RCT)等临床研究和综述。
仔细阅读所获证据,并对其真实性、重要性和实用性进行客观评价。按照目前公认的证据强度高低,首先查找有关的临床指南、系统评价/Meta分析和多中心大样本RCT。若没有则逐级降低查找单个大样本RCT结果、有对照但未用随机方法分组的研究、无对照的系列病例观察和单个病案等,最后检索专家意见和文献综述。其中系统评价首选Cochrane系统评价,并按照牛津循证医学中心对系统评价的评价标准进行筛选。
筛选后纳入机构共识1篇,各类临床研究5篇,文献综述8篇,社论1篇( 表1)。
| 表1 检索结果 |
T3cDM的治疗目标为控制高血糖症状和避免并发症。血糖控制是使HbA1c水平尽可能接近于正常,但须避免威胁生命的低血糖状态。与T1DM和T2DM一致,ADA建议T3cDM患者的HbA1c水平应低于7%[ 5, 20, 21],但由于T3cDM患者的依从性差、酗酒、不规律饮食及吸收不良等问题的影响,该治疗目标常难以达到。此外T3cDM患者血糖具有明显的脆性[ 22],易出现严重低血糖;因此控制血糖的治疗需个体化进行,宁可保持相对高血糖状态[ 8, 19]。
T3cDM治疗方法分为营养控制和血糖治疗。每日碳水化合物和能量摄入需依据患者体重和活动量决定。采取少量多次的方式进食,每日至少进食6次,饮食中需富含纤维素,减少脂肪、饱和脂肪酸、植物油摄入。由于CP的外分泌功能受损,营养吸收不良,限制能量摄入需采取谨慎的态度。胰酶替代治疗可减少代谢的不稳定性,戒酒可增进胰腺内分泌功能。
T3cDM的药物治疗方法可借鉴于T1DM和T2DM[ 5],与T2DM相同,包括胰岛素促分泌(磺脲类和格列奈类)、胰岛素增敏剂(格列酮类和双胍类)、影响糖吸收的药物(α糖苷酶抑制剂)和胰岛素的治疗。有关选择药物方面,目前尚无统一共识和标准。部分研究认为[ 7, 8, 13],大部分T3cDM可通过饮食、生活相关控制及口服降糖药物获得良好的血糖控制。口服降糖药物主要运用对象是轻型、早期病程和一般状态良好的T3cDM患者[ 20]。然而胰岛素增敏剂(双胍类和格列酮类)和碳水化合物吸收抑制剂(α糖苷酶抑制剂)应避免用于T3cDM患者[ 7, 17],因为T3cDM的发病机制是以胰岛素分泌缺乏为基础,同时并存明显消化不良。磺脲类促胰岛素分泌药物也不推荐对T3cDM患者运用,因为它可促进胰岛β细胞的过早耗竭[ 7, 15, 17]。也有研究认为,由于二甲双胍价格便宜、低血糖发生率低、降低胰岛素在糖代谢中的作用和特殊抗肿瘤作用,二甲双胍应作为T3cDM的一线治疗药物;即便需要胰岛素辅助控制血糖时,仍可继续服用[ 5]。国内研究者则进一步提出,因CP患者酒精嗜好者居多,所以T3cDM患者尽量不选用双胍类药物,以降低乳酸酸中毒的风险[ 19]。
针对控制饮食而无法稳定血糖的患者,胰岛素注射仍是治疗的首选[ 17, 19, 20]。方法是胰岛素的多重运用,即短效胰岛素每天3次和中效胰岛素睡前注射,睡前胰岛素用量通常比T1DM少得多;而并不推荐使用每天两次长效胰岛素注射的方法。需要指出的是,鉴于T3cDM患者血糖具有明显的脆性,胰岛素强化需相对保守,使血糖控制于偏高的水平。强化胰岛素的对象是以依从性良好的患者为主,并需经常监测血糖。Cui等[ 5]建议采取以“改变生活方式+二甲双胍+胰酶替代”为基础的递增式T3cDM治疗方案,若基础治疗后仍HbA1c>7%,则逐步选用1~4方案( 表2)。
| 表2 T3cDM递增治疗方案 |
如何应对T3cDM的血糖脆性并有效减缓胰岛β 细胞的过早耗竭,促进了新型控制血糖方案的产生。胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)被视为新的T3cDM治疗方法,部分研究认为其可提高胰岛素分泌,降低胰高血糖素,但不引起低血糖症状[ 11, 12]。但是内源性GLP-1易被体内二肽基肽酶4(dipeptidyl peptidase-4, DPP-4)分解而失去活性的事实,又催生了人GLP-1类似物及DDP-4抑制剂的诞生。有研究认为[ 23]:人GLP-1类似物(利拉鲁肽)在2型糖尿病患者早期应用可有效控制血糖,同时保护β细胞、减低体重,并降低肥胖患者糖尿病前期的患病率,带来多重获益。DPP-4抑制剂可选择性抑制DPP-4的活性,减少内源性GLP-1的降解,可作为治疗T2DM的一类新型药物[ 24]。然而T3cDM患者从GLP-1、GLP-1类似物或DPP-4抑制剂获取的利益多寡目前尚无定论。
根据以上检索证据和医生的临床经验,同时结合患者及其家属的意愿,我们制定以下最佳治疗方案。
患者CP确诊前有长期酗酒的个人史,首先继续逐步落实“减少酒精摄入,直至戒酒”的随访计划;其次,在前期胰酶替代有效(患者体重增加,慢性腹痛、脂肪泻等症状缓解)的基础上,继续胰酶替代治疗(胰酶肠溶胶囊 0.6 g 口服 3次/日),改善因外分泌功能不全而导致的消化功能不良和消瘦;第三,少量多次进餐,每日进餐6次,增加纤维素,减少脂肪和饱和脂肪酸摄入;最后,二甲双胍口服控制血糖(1 g口服2次/日),视血糖及HbA1c变化情况,必要时予以患者保守的强化胰岛素治疗。同时监测血糖,每3个月复查超声、肿瘤指标及上腹部CT,早期诊断可能发生的肿瘤。
患者于2011年2月自愿加入随访计划,于2012年2月出现T3cDM症状。经戒酒、饮食调整、胰酶替代及二甲双胍治疗,获得较好血糖控制。在5个月(2012年2月至7月)的2次随访期内,暂未发现胰腺肿瘤性病变,CA19-9等肿瘤指标未见异常。然而可预测,随着胰腺实质细胞的继续损伤、内外分泌功能的进行下降,患者仍需进一步调整药物或强化胰岛素治疗,其面临的CP癌变风险也逐渐加大。
国内CP导致T3cDM的随访工作虽然已在部分单位开展[ 26],但是其随访的有效性、肿瘤预防效果评价及社会经济效益比值等仍无法完全回答;该领域的过多空白,依然需要广大研究人员的加入,共同探讨。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|