作者简介: 查成喜(1986-),男,兰州人,硕士研究生,研究方向为生物医学诊断技术。
目的利用Meta分析的方法评估氯吡格雷抗血小板作用的效果和细胞色素P450 2C19基因(CYP2C19)多态性之间的相关性。方法计算机检索中国知网、万方、维普、中国生物医学文献数据库、Cochrane 图书馆、SCI、EMBASE和PubMed数据库,并手工检索相关杂志,收集氯吡格雷使用患者CYP2C19 A/G位点多态性的基因频率和抗血小板效应的独立病例对照研究,提取有效的数据,用RevMan 5.0软件进行Meta分析。结果共纳入8个病例对照研究,包括1 538例GG基因型患者和4 413例GA或者AA患者。Meta分析结果表明:使用氯吡格雷作为抗血小板药物的患者中,CYP2C19 突变型(GA或者AA) 携带者比野生型GG携带者的药物敏感性差[比值比=0.23,95% 可信区间(0.13,0.40)];血浆药物浓度前者远低于后者[均数差=-17.38,95% 可信区间(-25.59,-9.16)];血小板反应指数前者较后者明显降低[均数差=12.87,95%可信区间(8.48,17.26)];支架植入后血栓形成情况前者较后者有明显增加[比值比=3.68,95%可信区间(2.17,6.24)];血栓导致的死亡率前者也较后者增高[比值比=3.68,95%可信区间(1.82,7.43)];然而,对于心肌梗死的情况前者与后者之间无差异[比值比=1.25,95%可信区间(0.96,1.63)]。结论Meta分析结果表明,CYP2C19基因多态性与氯吡格雷药物反应作用之间存在着一定的相关性,且易导致由于血小板凝集而造成的患者死亡。
Objective To assess antiplatelet efficiency for patients with cytochrome P450 polymorphisms using Clopidogrel.Method A comprehensive electronic search was carried out and 8 independent studies with a maximum of 1 538 cases and 4 413 controls were analyzed using the Cochrane Collaboration’s RevMan 5.0 software.Results Eight studies met the included criteria. There were statistically significant differences between loss-of-function CYP2C19 (GA or AA) and wild genotype(GG) for the response status to Clopidogrel: the fixed effects odds ratio(OR) was 0.23 [95% confidence interval(CI) 0.13 to 0.40]; for the plasma concentration levels of Clopidogrel: the random effects MD was -17.38(95% CI -25.59 to -9.16); for the platelet reactivity index of Clopidogrel: the random effects MD was 12.87 [95% CI 8.48 to 17.26]; for the definite stent thrombosis: the fixed effects OR was 3.68 (95% CI 2.17 to 6.24); for death of patients: the fixed effects OR was 3.68 (95% CI 1.82 to 7.43); however, there were no statistically significant differences between GA or AA and GG for myocardial infarction (MI): the fixed effects OR was 1.25 [95% CI 0.96 to 1.63].Conclusions The presence of the loss-of-function CYP2C19 is associated with low plasma concentration, response status and antiplatelet efficacy of Clopidogrel and indicators of efficacy except for MI in patients using clopidogrel as antiplatelet agent.
随着社会不断发展和老龄化现象的加重,血栓栓塞性疾病及其并发症发病率越来越高,患者血小板粘附、释放、聚集形成血栓或栓塞是导致心、脑和外周血管事件的最后关键环节,是致死和致残的直接原因,在预防治疗血栓栓塞性疾病时,氯吡格雷是预防动脉粥样硬化患者缺血性事件最有效的药物[ 1, 2, 3]。氯吡格雷须由肝细胞色素P450同工酶代谢后才能有选择性地不可逆结合血小板二磷酸腺苷(adenosine diphosphate,ADP)受体-P2Y12发挥抗血小板聚集功能[ 4, 5]。但是有研究报道,大约有20%~40%的患者对氯吡格雷敏感性低甚至无应答,从而导致对ADP诱导的血小板聚集有低或无抑制性[ 6, 7, 8, 9, 10, 11]。研究在健康人中通过血小板光学集合度测定表明,受体P2Y12基因多态性影响ADP诱导的血小板活化过程[ 12]。然而,未能发现受体P2Y12基因多态性与ADP诱导的血小板聚集有明显的相关性[ 13, 14, 15, 16, 17],但细胞色素P450基因包括 CYP1A2、CYP2B6、CYP2C9、CYP2C19、CYP3A4和CYP3A5均参与氯吡格雷活化[ 18, 19, 20, 21, 22], CYP2C19是氯吡格雷活化过程的关键酶[ 23, 24]。因此,本研究利用Meta分析旨在总结评价CYP2C19基因681G>A多态性与氯吡格雷反应程度之间的相关性,为临床合理使用氯吡格雷提供科学指导。
以“细胞色素P450、多态性和氯吡格雷”为关键词检索中国生物医学数据库(CBM)、中国学术期刊全文数据库(CNKI)、万方科技期刊全文数据库、重庆维普中文科技期刊全文数据库(VIP)进行文献检索,并辅以文献追溯的方法收集相关中文文献;以“cytochrome P450、CYP 450、clopidogrel” 联合“polymorphism、 polymorphisms、 gene”或者“genotype”为关键词检索PubMed、Cochrane图书馆(英文)、科学引文索引(SCI)、EMBASE数据库中发表的相关文献,文献检索时间截止2011年12月,文献语言不做限制。
纳入标准:①氯吡格雷效应与CYP2C19基因多态性之间的分析;②研究对象以氯吡格雷作为抗血小板治疗方案的病人,分析了CYP2C19基因多态性。
排除标准:①会议摘要、病例报道、评论和综述类文章;②原始文献内容未涉及CYP2C19基因多态性研究;③原始文献研究对象不是人类;④重复报道、数据描述不清的研究。
根据纳入和排除标准,由2人分别提取研究设计类型、研究对象基线、预期结果、干预措施、报道结果等。数据提取过程中如果遇到分歧,通过讨论或由第三位研究者协助解决。
采用Cochrane 图书馆协作网RevMan 5.0统计学软件进行Meta统计分析[ 25]。先对各个文献进行异质性检验,并根据检验结果选取相应的数据合并。若文献同质( P>0.1)则采用固定效应模型进行合并分析,反之,如果各文献之间有异质性则采用随机效应模型。计数资料采用比值比(odds ratio,OR)及其95%可信区间(confidence interval,CI)描述,计量资料采用均数差(mean difference,MD)及其95%CI描述,检验水准为α=0.05。
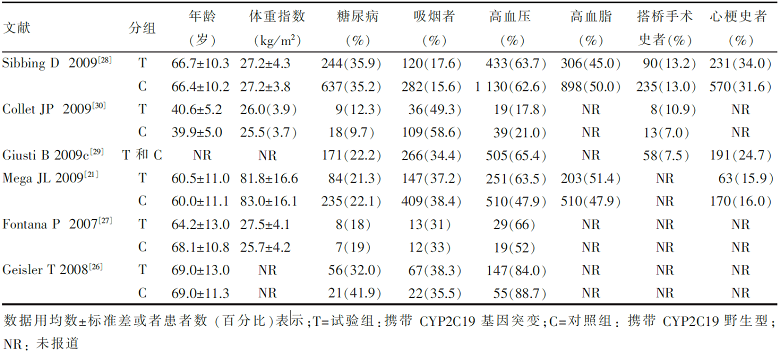
我们最初检出相关文献168篇,剔除重复数据、未能获得完整数据、信件、评论、综述和不符合纳入标准的文献160篇,最终8篇文献纳入研究,其中6篇文献研究对象基线如 表1所示,另外2篇文献没有完整基线数据,但是在文献中已经申明研究对象之间基线无统计学意义的差异,因此我们也将这2篇文献纳入研究范围[ 22, 23]。
| 表1 纳入文献研究对象基线 |
2.2.1 CYP2C19基因多态性与氯吡格雷敏感状态的关系
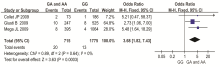
2篇文献报道了氯吡格雷敏感状态与CYP2C19基因多态性的关系[ 22, 26]。异质性检验结果表明研究之间无统计学异质性(χ2=0.11, P=0.74),故采用固定效应模型进行合并分析。高敏感组有231例,低敏感组有80例,以A等位基因为暴露因素,G等位基因为非暴露因素。结果显示,有A等位基因的人群(AA组和GA组)对氯吡格雷的敏感性明显低于有G等位基因的人群(GG组)[OR=0.23,95%CI(0.13,0.40)],差异有统计学意义( P<0.05),统计结果见 图1。
2.2.2 CYP2C19基因多态性与氯吡格雷血浆浓度的关系
2篇文献报道了氯吡格雷血浆浓度与CYP2C19基因多态性的关系[ 22, 23]。异质性检验结果表明研究之间存在统计学异质性(χ2=6.85, P=0.03),故采用随机效应模型进行合并分析。GG组有128例,GA组有25例,AA组有9例。结果显示,给予相同量的氯吡格雷,经过相同时间后检测,AA组和GA组血浆药物浓度明显低于GG组[MD=-17.38,95%CI(-25.59,-9.16)],差异有统计学意义( P<0.05),统计结果见 图2。
2.2.3 CYP2C19基因多态性与血小板反应指数的关系
2篇文献报道了血小板反应指数与CYP2C19基因多态性的关系[ 23, 27]。研究中分别用5 μmol/L ADP 诱导后血小板的反应指数来表征氯吡格雷抗血小板效应。异质性检验结果表明研究之间存在统计学异质性(χ2=19.93, P=0.000 2),故采用随机效应模型进行合并分析。结果显示:GA 或者AA基因携带者比GG携带者表现出更低的PRI,也就是说前者中氯吡格雷的抗血小板效应较后者低 [MD=12.87,95%CI(8.48,17.26)],差异有统计学意义( P<0.05),统计结果见 图3。
2.2.4 CYP2C19基因多态性与支架植入后血栓形成的关系
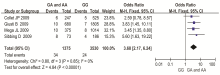
4 篇文献报道了支架植入后使用氯吡格雷作为抗血栓药物,探究了血栓形成与CYP2C19基因多态性的关系[ 21, 28, 29, 30]。异质性检验结果表明研究之间无统计学异质性(χ2=0.80, P=0.85),故采用固定效应模型进行合并分析。GG组有3 530例,GA组和AA组有1 375例。结果显示,在支架植入后使用氯吡格雷作为抗血栓药物患者中,AA组和GA组血栓形成的例数明显高于GG组[OR=3.68,95%CI(2.17,6.24)],差异有统计学意义( P<0.05),统计结果见图4。
2.2.5 CYP2C19基因多态性与血栓造成的死亡事件的关系
3篇文献报道了血栓造成的死亡事件与CYP2C19基因多态性的关系[ 21, 29, 30]。异质性检验结果表明研究之间无统计学异质性(χ2=0.89, P=0.64),故采用固定效应模型进行合并分析。GG组有1 775例,GA组和AA组有715例。结果显示,在发生由于血栓造成的死亡事件方面,AA组和GA组死亡率明显高于GG组[OR=3.68,95%CI(1.82,7.43)],差异有统计学意义( P<0.05),统计结果见 图5。
2.2.6 CYP2C19基因多态性与心肌梗死事件的关系
2篇文献报道了心肌梗死事件与CYP2C19基因多态性的关系[ 21, 28]。异质性检验结果表明研究之间无统计学异质性(χ2=0.44, P=0.51),故采用固定效应模型进行合并分析。GG组有2 869例,GA组和AA组有1 075例。结果显示,在发生心肌梗死事件方面,AA组和GA组与GG组无差别[OR=1.25,95%CI(0.96,1.63)],差异无统计学意义( P>0.05),统计结果见 图6。
联合国世界卫生组织统计,全球死亡患者中,三分之一是死于不合理用药,而非死于自然疾病本身。每个人的用药效果和副作用不同,是因为每个人的药物反应相关基因型不同,当前世界卫生组织正在倡导个体化用药,实现最高的疗效、最小的毒副作用。本研究首次利用Meta分析方法综合评价使用氯吡格雷作为抗血小板药物的患者疗效情况与CYP2C19基因多态性的相关性,研究结果表明CYP2C19基因多态性与患者对氯吡格雷的反应程度、血浆药物浓度、血小板反应指数及由于血栓导致的不良事件等方面都存在着相关性,CYP2C19功能缺失型(GA和AA)相比正常型(GG)对氯吡格雷的反应程度、抗血栓功效更差、血浆有效药物浓度更低,不良事件发生率更高。这主要是由于CYP2C19基因的突变导致氯吡格雷无法或者只有少量的被代谢为活性药物成分,从而不能抑制由于ADP诱导的血小板凝集活化。
2007年6月卫生部将P450家族代谢酶基因突变检测列入最新医疗机构临床检验项目目录,支持开展基于基因分型的个人合理用药。当前的医疗药物中95%以上都有一定的毒副作用,每个人用药的反应都不同,有人疗效好、毒副作用小;有人疗效差、毒副作用大。这主要就是因为每个人的用药反应基因P450家族代谢酶基因型不同。基因型不同,药效则不同,毒副反应也不同;适用药不同,适用药量也不同。个体化合理用药方法,能够选择最合适的药,用最合适的剂量,做到效果最好、毒性最小、花钱最少。因此,我们建议临床医师在使用氯吡格雷之前建议患者检测CYP450基因多态性,合理用药,达到最佳效果,减少不良事件的发生。
在我们的研究中,还有一些不足之处。首先,由于纳入文献中人群的种族背景不是很清楚,无法进行种族之间的亚组比较;其次,由于患者分布的年龄段较宽,绝大部分研究数据没有年龄分层段的数据,因此我们没有进行年龄段的亚组分析;最后,大多数研究未能报道基因型检测技术,不能有效地评价基因型检测的准确度。另外,纳入文献全部为外文文献,没有合适的中文文献,不能很好地反应中国在这方面的研究现状,但是本研究的结果表明在患者中使用氯吡格雷的确与其CYP2C19基因多态性存在着相关性,同样对东方人群也是有一定指导意义的。
因此,在进一步的研究中,为了获得更加详实有说服力的数据资料,开展统一规划的使用相同基因型检测技术、针对不同种族人群、最佳药物剂量和盲法的临床试验研究,为合理有效使用药物,减少不良事件发生奠定基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|