作者简介:曹彦(1983-),女,湖南常德人,博士研究生,从事免疫学研究。
目的以结核菌素试验为参考标准,系统评价γ干扰素释放试验在诊断实体器官移植术前患者潜伏结核感染的临床价值。方法计算机检索PubMed、EMBASE、Cochrane 图书馆,检索时间为建库至2012年8月,全面收集γ干扰素释放试验诊断实体器官移植术前患者潜伏结核感染的研究。用Meta Disc 1.4软件对其合并的特异度、敏感度、阴性似然比、阳性似然比等进行分析,绘制综合受试者工作特征曲线。结果最终纳入6个包括QFT-IT试验和T-SPOT试验的γ干扰素释放试验的研究。QFT-IT试验和T-SPOT试验对实体器官移植术前患者潜伏结核感染的诊断价值的合并特异度、合并敏感度、合并阳性似然比、合并阴性似然比、合并诊断比值比及综合受试者工作特征曲线下面积分别为81%、74%、3.94、0.33、12.44、0.847 8 和78%、75%、3.61、0.32、12.07、0.845 0。结论经综合受试者工作特征曲线证实,γ干扰素释放试验在实体器官移植术前患者潜伏结核感染诊断中,不适用于结核感染的筛查,也不适合进一步鉴别诊断移植术前患者是否处于潜伏结核,上述结果尚需更多科学的、设计严谨的临床试验进一步证实。
Objective To assess the diagnostic value of IGRA for latent tuberculosis infection in solid organ transplant recipients.Methods We searched PubMed,EMBASE and Cochrane library to evaluate the evidence of using QuantiFERON-TB Gold in-tube (QFT-IT) and T-SPOT on blood for the diagnosis of latent tuberculosis infection in solid organ transplant recipients. Meta Disc 1.4 was used to handle data from included studies.Results The search identified 6 eligible studies that included 751 transplant recipients before transplantation. Compared with TST, the summary values of specificity,sensitivity, positive likelihood ratio, negative likelihood ratio,OR,and SROC curve of QFT-IT and T-SPOT were 81%,74%,3.94,0.33,12.44,0.847 8 and 78%,75%,3.61,0.32,12.07,0.845 0, respectively.Conclusion IGRA in their current formulations has limited accuracy in diagnosing latent tuberculosis infection in transplant recipients, and should not be used alone to rule out or rule in latent tuberculosis infection in transplant recipients. Further modification is needed to improve their accuracy.
结核病是器官移植患者的主要易感疾病之一[ 1, 2]。据报道,器官移植患者对结核的易感性明显高于普通人群,结核病的发病率是普通人群的20~70倍[ 3]。结核菌可直接或者通过药物相互作用导致移植物功能障碍,常用结核治疗药物利福平可以诱导肝脏产生细胞色素P450,降低钙调节神经磷酸酶抑制剂水平,从而引起移植物排斥,使患者死亡率大大增高[ 4, 5]。因此,美国移植协会建议所有器官移植患者术前通过X线胸片、结核菌素皮肤试验(tuberculin skin test,TST)等方法检查结核菌感染情况[ 6]。目前,临床主要采用TST诊断潜伏结核,但TST很容易受抗原交叉反应的影响,不能区分是卡介苗(bacillus Calmette-Guerin,BCG)接种的免疫反应还是结核分枝杆菌或环境分枝杆菌的自然感染,从而导致假阳性,影响诊断的准确性[ 3, 4]。
干扰素释放试验(interferon gamma release assays,IGRA)是一种用于体外免疫检测结核杆菌感染的新方法,它包括QFT-IT 和T-SPOT试验,它利用结核分枝杆菌所分泌的特有的蛋白早期分泌性抗原靶-6(early secretory antigenic target 6, ESAT-6)和培养滤液蛋白-10(culture filtrate protein-10,CFP-10)良好的免疫原性,刺激结核病患者外周血单核细胞分泌γ干扰素(γ-interferon,IFN-γ),这些产生IFN-γ 的T 细胞可被极其敏感的ELISA 或ELISPOT 方法检测到[ 7, 8, 9, 10, 11]。据报道IGRA用于诊断结核感染较TST特异性和敏感性高,且不易受BCG接种和大多数非致病分枝杆菌的影响[ 7, 8, 9, 10, 11, 12, 13]。本研究为了客观评价IGRA在诊断实体器官移植术前患者潜伏结核的临床实用性,采用Cochrane 系统评价的方法,对全世界已发表、未发表及在研的IGRA 诊断实体器官移植术前患者潜伏结核的试验进行系统评价,以期为临床应用提供参考。
同时符合以下条件的文献被纳入:①潜伏结核菌感染定义为TST阳性但诊断为非活动性结核病[ 14];②以TST 为参照,用IGRA诊断移植术前患者潜伏结核感染的诊断性试验,且能获得IGRA诊断潜伏结核菌感染的真阳性值(true positive,TP)、假阳性值(false positive,FP)、真阴性值(true negative,TN)和假阴性值(false negative,FN)的文献;③IGRA包括QFI-IT试验和T-SPOT试验;④纳入文献研究对象为实体器官移植术前的患者人群。年龄大于18岁,排除已通过痰培养、胸片或其他方式证实是活动性结核的患者;⑤纳入文献研究人群中不包含艾滋病病毒感染者。
以transplant、 tuberculosis、 latent tuberculosis infection、 interferon-gamma、 QFT、 QFT-G、 TSPOT、T-cell assays、ESAT-6、GFP-10 等为主要检索词检索EMBASE、PubMed、Cochrane 图书馆。如试验报告不详或资料缺乏,通过信件与作者联系获取。
曹彦和王心静共同设计信息资料提取表并分别提取和录入资料后核对,提取的主要资料包括:作者、年代、国家、纳入样本数、试验方法等,如遇分歧通过讨论或与第三位研究者讨论解决。
依据Whiting等制定的QUADAS(quality assessment of diagnostic accuracy studies)14条标准评价文献质量[ 15],分别对14个条目按“是”(满足此标准)、“否”(不满足或未提及)、“不清楚”(部分满足或者从文献中无法得到足够信息)3个判断标准进行评价。由2名评价者独立评价文献质量,遇有分歧时通过讨论解决。
用Meta Disc 1.4软件进行数据统计学处理。对纳入研究的文献,计算合并敏感度(sensitivity,SEN)、合并特异度(specificity, SPE)、阳性似然比(positive likelihood ratio, PLR)、阴性似然比(negative likelihood ratio, NLR)、诊断优势比(diagnostic odds ration, DOR)。对DOR结果采用 2检验进行异质性分析,显著性水平设定为α=0.1,用 I2评估异质性大小, I2<25%则异质性较小,25%< I2<50%则为中等度异质性, I2>50%则研究结果间存在高度异质性。若研究间无异质性,采用固定效应模型进行合并分析;存在中等程度以上的异质性时选用随机效应模型进行合并分析,随后再进行敏感性分析。绘制综合受试者工作特征(summary receiver operating characteristic,SROC)曲线,并计算曲线下面积(area under the curve,AUC)和Q∗指数。
初检出文献163篇。除去重复文献56篇后,阅读文章标题及摘要排除综述、无严格对照及其它类型的研究等143 篇,初步纳入文献20 篇。进一步阅读全文排除未达到纳入标准的文献14篇。最终纳入6个研究[ 16, 17, 18, 19, 20, 21],共751例患者。
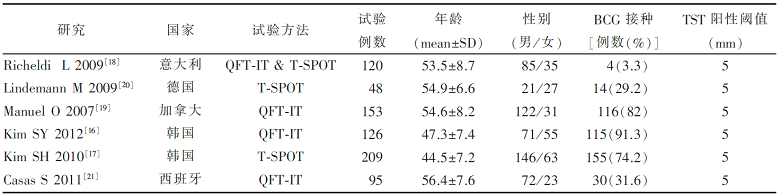
各纳入研究的基本特征见 表1,纳入6个研究751例患者。2 个研究来自韩国[ 16, 17], 1 个研究来自意大利[ 18],1 个研究来自加拿大[ 19],1 个研究来自德国[ 20],1 个研究来自西班牙[ 21]。其中4个研究评价QFT-IT和TST试验,共有研究对象494例[ 16, 18, 19, 21]; 3个研究评价T-SPOT和TST试验,共有研究对象377 例[ 17, 18, 20]。
| 表1 纳入研究的基本特征 |
6篇均符合QUADAS标准中的12项条目(疾病谱组成,选择标准,金标准,疾病进展偏倚,部分参照偏倚,多重参照偏倚,混合偏倚,待评价试验的实施,金标准的实施,试验解读偏倚,金标准解读偏倚, 临床解读偏倚)。另2个条目描述如下:1篇未对报告中的中间试验结果作出解释[ 20],1篇对退出的病例没有作出解释[ 21], 1篇无法从文献中对退出病例得到足够信息[ 19]。具体见 表2。
| 表2 纳入研究的质量评价 |
2.4.1 QFT-IT 法诊断实体器官移植术前患者潜伏结核感染
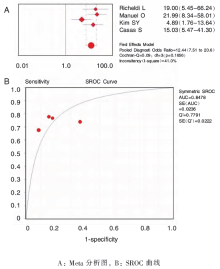
以TST作为参考试验,4个研究报道了QFT-IT 诊断移植术前患者潜伏结核的诊断价值[ 16, 17, 19, 21],异质性检验为敏感度 I2=0%, P=0.788;特异度 I2=87.9%, P=0.000;PLR I2=83.2%, P=0.000;NLR I2=0%, P=0.797;DOR I2=41%, P=0.166,提示研究具有同质性,采用固定效应模型进行Meta 分析,结果显示合并敏感度为74%(65%~81%)、合并特异度为81%(76%~85%)、合并PLR 为3.94(3.02~5.14)、合并NLR 为0.33(0.24~0.44)、合并DOR 为12.44(7.51~20.62)。SROC 下面积为0.847 8[SE(AUC)=0.023 6], Q∗为0.779 1( 图1)。
2.4.2 T-SPOT 法诊断实体器官移植术前患者潜伏结核感染
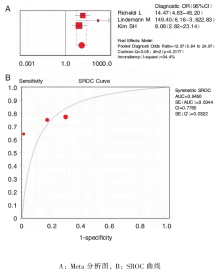
以TST作为参考试验,3个研究报道了T-SPOT 诊断移植术前患者潜伏结核的诊断价值[ 17, 18, 21],异质性检验为敏感度 I2=0%, P=0.874;特异度 I2=92.6%, P=0.000;PLR I2=74.7%, P=0.019;NLR I2=0.0%, P=0.961;DOR I2=34.4%, P=0.218,宜采用固定效应模型进行Meta 分析,结果显示合并敏感度为75%(60%~86%)、合并特异度为78%(73%~83%)、合并PLR 为3.61(2.75~4.75)、合并NLR 为0.32(0.20~0.52)、合并DOR 为12.07(5.84~24.97)。SROC 下面积为0.845 0[SE(AUC)=0.034 4],Q* 为0.776 5( 图2)。
器官移植患者并发结核感染导致患者死亡率大大增高,因此,对其潜伏性结核感染的靶向检测诊断和治疗是结核控制的重要组成部分。在美国和欧洲多个国家,目前有两种IGRA试剂盒被批准用于临床检测[ 22, 23]。国内外的许多研究也表明其对于结核分枝杆菌潜伏感染的诊断具有很高的敏感性和特异性[ 24, 25, 26]。但IGRA的操作费用远高于TST,并且它在免疫抑制人群中的诊断价值仍有争议[ 27, 28]。现阶段,临床上对其诊断实体器官移植患者潜伏性结核感染的报道缺乏系统的分析,多为小样本的病例分析,因此,本研究采用诊断试验的系统评价方法对IGRA在实体器官移植患者潜伏性结核感染诊断中的价值进行分析。
本系统评价以结核菌素试验作为参考标准,纳入了6 个IGRA诊断研究。QFT-IT法诊断移植术前患者潜伏结核感染的合并敏感度为74%(65%~81%)、合并特异度为81%(76%~85%),漏诊率为26%,误诊率为19%,说明QFT-IT 试验可用于进一步的诊断。似然比属于同时反映灵敏度和特异度的复合指标,当PLR大于10且NLR小于0.1时,具有令人信服的诊断效力,当PLR大于5且NLR小于0.2时,具有较强的诊断效能[ 25]。本研究中QFT-IT 法诊断移植术前患者潜伏结核感染的合并PLR 为3.94(3.02~5.14),提示QFT-IT试验结果为阳性时,不能确诊患者是潜伏结核感染;合并NLR 为0.33(0.24~0.44),提示QFT-IT 试验结果为阴性时,患者可基本排除感染结核菌的可能性。SROC曲线分析法不受阈值变化的影响,通过计算曲线下的面积及Q∗值大小可以进一步显示诊断试验准确度的高低,SROC曲线下面积在0.5~0.7之间时诊断价值较低,在0.7~0.9之间时诊断价值中等,在0.9以上时诊断价值较高[ 26]。本研究中QFT-IT 法SROC 下面积为0.847 8[SE(AUC)=0.023 6],Q*为0.779 1,均较接近1,说明其诊断效能中等。T-SPOT 法诊断移植术前患者潜伏结核感染的合并敏感度为75%(60%~86%)、合并特异度为78%(73%~83%),漏诊率为25%,误诊率为22%,说明T-SPOT试验可用于进一步的诊断。合并PLR 为3.61(2.75~4.75),提示T-SPOT 试验结果为阳性时,患者为潜伏结核感染的可能性较低;合并NLR 为0.32(0.20~0.52),提示T-SPOT 试验结果为阴性时,患者可基本排除感染结核菌的可能性。SROC 下面积为0.845 0[SE(AUC)=0.034 4],Q* 为0.776 5,均较接近1,说明其诊断效能中等。提示QFT-IT和T-SPOT试验均适用于进一步鉴别诊断实体器官移植术前患者是否处于潜伏结核菌感染,但因敏感度较低而不适用于筛查。
结合QUADAS质量评价结果,本系统评价最终纳入的研究间质量差异不是很大。关于偏倚的金标准、部分参照偏倚、多重参照偏倚、临床解读偏倚、混合偏倚,6篇文献均进行了描述,1篇对退出的病例没有做出解释,1篇对退出病例描述不充分,提示纳入文献的偏倚控制较好;变异的2项条目疾病谱组成和选择标准6篇文献均有描述,提示纳入文献的变异较小;纳入文献均报告了待评价试验的实施、金标准实施的信息和难以解释的试验结果,提示纳入研究的报告质量较好。说明本Meta 分析的证据强度较高。
本研究的不足之处和局限性: ①潜伏结核感染的诊断目前缺乏金标准,以TST 试验为参照试验可能影响本系统评价结果的可靠性;②各研究间的试验对象的来源不同,BCG接种率存在一定差异,实体器官移植及疾病分级不同,可能影响文献的质量和合并分析;③仅检索了公开发表的文献,未检索灰色文献和正在进行的研究,仅纳入了中英文的文献,可能存在发表偏倚和语种偏倚。
当前证据表明,IGRA适用于进一步鉴别诊断实体器官移植术前患者是否处于潜伏结核菌感染,但不适用于结核感染的筛查。上述结果仍需更多前瞻性的、设计合理的、多中心随机对照试验去探索。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|