引用本文

吴一龙, 王长利, 廖美琳, 陆舜, 周彩存, 傅小龙, 钟文昭, 毛伟敏, 程颖, 卢铀, 刘云鹏, 王洁, 黄诚, 冯继锋, 周清华, 蒋国樑, 王俊, 王绿化, 陈晓媛, 马胜林, 王群, 张力, 王震, 白春学, 常建华, 陈刚, 陈海泉, 陈克能, 程刚, 崔久嵬, 范云, 顾春东, 韩宝惠, 侯梅, 胡成平, 胡艳萍, 焦顺昌, 李峻岭, 李伟雄, 梁军, 刘晓晴, 马智勇, 乔贵宾, 申屠阳, 宋启斌, 宋恕平, 宋向群, 宋勇, 王建军, 王思愚, 伍钢, 熊建萍, 许林, 杨衿记, 杨学宁, 于丁, 于世英, 张贺龙, 张力, 张绪超, 张沂平, 赵明芳, 赵琼, 周建英, 朱广迎. 明智选择:常见的肺癌治疗决策. 循证医学,2014,14(3): 129-135
WU Yi-long, WANG Chang-li, LIAO Mei-lin, LU Shun, ZHOU Cai-cun, FU Xiao-long, ZHONG Wen-zhao, MAO Wei-min, CHENG Ying, LU You, LIU Yun-peng, WANG Jie, HUANG Cheng, FENG Ji-feng, ZHOU Qing-hua, JIANG Guo-liang, WANG Jun, WANG Lü-hua, CHEN Xiao-yuan, MA Sheng-lin, WANG Qun, ZHANG Li, WANG Zhen, BAI Chun-xue, CHANG Jian-hua, CHEN Gang, CHEN Hai-quan, CHEN Ke-neng, CHENG Gang, CUI Jiu-wei, FANG Yun, GU Chun-dong, HAN Bao-hui, HOU Mei, HU Cheng-ping, HU Yan-ping, JIAO Shun-chang, LI Jun-ling, LI Wei-xiong, LIANG Jun, LIU Xiao-qing, MA Zhi-yong, QIAO Gui-bin, SHEN Tu-yang, SONG Qi-bin, SONG Shu-ping, SONG Xiang-qun, SONG Yong, WANG Jian-jun, WANG Si-yu, WU Gang, XIONG Jian-ping, XU Lin, YANG Jin-ji, YANG Xue-ning, YU Ding, YU Shi-ying, ZHANG He-long, ZHANG Li, ZHANG Xu-chao, ZHANG Yi-ping, ZHAO Ming-fang, ZHAO Qiong, ZHOU Jian-ying, ZHU Guang-ying. Choosing Wisely: Common Decision of Lung Cancer Therapy.
Journal of Evidence-Based Medicine,2014,14(3): 129-135

Copyright©2014《循证医学》杂志 版权所有
2014年3 月6-7 日,中国抗癌协会肺癌专业委 员会和中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)联合主办了第十一届“中 国肺癌高峰论坛”。本届高峰论坛讨论了常见肺癌 治疗决策的几个问题。专家们认为,我们在临床实 践中做出一项用于患者的医疗措施,必须符合以下 四大原则: 得到循证医学证据支持(supported by evidence)、不重复已做过的类似检查或操作(not duplicative of other tests or procedures already received)、免于伤害(free from harm)、真正必须 (truly necessary)。经过激烈讨论形成了以下共识。
本共识的共识级别为:
1A 级:基于高水平证据(严谨的Meta 分析或 RCT 结果),专家组有统一认识;
1B 级:基于高水平证据(严谨的Meta 分析或 RCT 结果),专家组有小争议;
2A 级:基于低水平证据,专家组有统一认识;
2B 级:基于低水平证据,专家组无统一认识, 但争议不大;
3 级:专家组存在较大争议。
1 共识一: 在和患者及其家属讨论治疗获 益、潜在危害和高昂费用之前,不要给各 期肺癌患者进行细胞生物免疫治疗共识级别:1B。
目前国内开展的“细胞生物免疫治疗”,其含义 为运用生物技术和生物制剂对从患者体内采集的免疫细胞进行体外培养和扩增后回输到患者体内的方 法。目前绝大部分的免疫回输细胞为树突状细胞 (dendritic cell, DC), 细胞因子诱导的杀伤细胞 (cytokine activated killer cells, CIK)和自然杀伤细 胞(natural killer cell,NK)。其前身为上个世纪80 年 代所谓的淋巴因子激活的杀伤细胞(lymphokine activated killer cells, LAK) 和肿瘤浸润淋巴细胞 (tumor infiltrating lymphocyte, TIL)。1985-1986 年 美国癌症研究所的Rosenberg 报道了使用LAK 和 TIL 成功治疗几例肾癌和黑色素瘤后,这种疗法在全 球尤其在中国引起研究的热潮。可惜中国大部分地 方是借研究之名而临床滥用为实,结果导致LAK 和 TIL 昙花一现而进入静寂期。进入21 世纪后,LAK 和TIL 改头换面,变成了DC、CIK 和NK 等等再度悄 然兴起。这一波略不同于既往,确实有个别单位进行 了临床研究, 例如2004-2005 年上海韩宝惠团队进 行了化疗联合树突状细胞/ 细胞因子诱导的杀伤细 胞(DC/ CIK)治疗晚期肺癌研究,28 例患者,研究组 的疾病进展时间(time to progression,TTP)较对照组 显著延长(6.9 个月vs. 5.2 个月,P=0.03),但生存率 无差别[ 1]。进一步的前瞻性随机对照研究,扩大样本 量至60 例,增加给药次数,TTP 显著延长(7.3 个月 vs. 6.2 个月,P=0.034)。两组的1 年、2 年、3 年生存率 显著延长(63.3%、30%、23% vs. 56.7%、13.3%、6.7%, P=0.037)[2]。国内另一项队列研究, 对照组61 例化 疗,试验组61 例化疗联合DC/ CIK。结果化疗+DC/ CIK 组比单独化疗组的1 年和2 年生存率明显提高 (57.2%、27% vs. 37.3%、10.1%,P<0.05)[ 3]。
表1列举了文献报道的系列临床研究的结 果。从 表1 可看出,肺癌细胞生物免疫治疗的临 床研究, 多为单中心、小样本、单组、回顾性的非 严格随机对照研究(randomized controlled trial RCT), 少数的前瞻性研究也是小样本的临床试 验, 因此,肺癌的细胞生物免疫治疗总体上缺乏 级别较高的大规模随机对照临床研究证据,目前 也缺乏潜在危害的评估,而且费用昂贵。
近年来,肺癌的免疫治疗取得了长足的进步,特 别是在阻断引起免疫逃避的检查点(checkpoint)、 有效的抗原提呈和T 细胞受体镶嵌抗原上都曙 光初现, 如CTLA4 和PD1 抑制剂Ipilimumab 及 Nivolumab 治疗晚期肺癌[ 12 13 14]、Sipuleucel-T 疫苗治 疗前列腺癌[ 15], CARs 治疗儿童白血病,均延长了 生存期。这些新的免疫治疗方法,显然不同于单纯 扩增免疫细胞那么简单。
表1
表1
 表1 文献报道的临床研究结果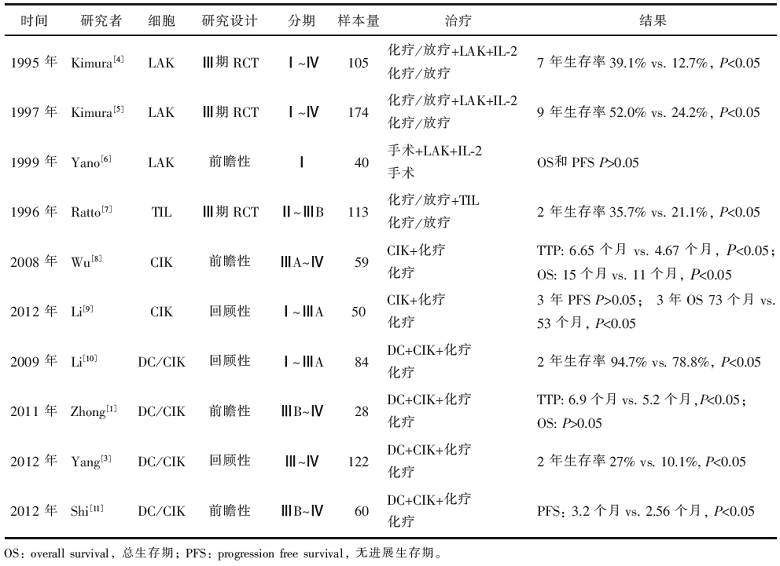 | 表1 文献报道的临床研究结果 |
鉴于缺乏确认性的临床随机对照研究的结果, 理论上单纯的扩增相关的生物细胞在免疫治疗上 的合理性不足,因此,专家们建议肺癌的细胞免疫 治疗应该进行“明智选择”。现场调查显示,参会专 家40%不会给肺癌患者推荐生物治疗,30%偶尔推 荐,26%很少推荐,4%常常推荐。56%的专家建议进 行随机对照临床试验,17%不推荐临床实践使用, 13%认为没有循证医学证据,但对患者有好处,8% 认为是目前最热门的癌症免疫治疗的重要组成, 6%认为已有高级别循证医学证据,可在临床应用。
2 共识二:仅有血清标志物(如CEA)的升 高而没有影像学进展的证据时, 不要改 变肺癌原有的治疗策略共识级别:2A。
1978 年Herberman 在美国国立癌症研究所召 开的人类肿瘤免疫诊断会上首先提出肿瘤标志物 的概念, 肿瘤标志物是指特征性存在于恶性肿瘤 细胞,或由恶性肿瘤细胞异常而产生,或由宿主对 肿瘤的刺激反应而产生,能反映肿瘤发生、发展, 监测肿瘤对治疗反应的一类物质。肿瘤标志物存 在于肿瘤患者的组织、体液和排泄物中,能够用免 疫学、生物学及化学的方法检测。
2005年美国临床生物化学学会(NACB) 关于 肺癌血清肿瘤标志物的应用建议是: 在无症 状或高危人群中, CYFRA21-1、癌胚抗原(carcino embryonie antigen,CEA)、NSE 和ProGRP 不能用做 肺癌筛查。病理类型未知时,需要检测所有指标。
血清NSE 和ProGRP(尤其ProGRP )升高提示小细 胞肺癌可能,SCCA 升高提示鳞癌可能。无症状的 肺癌患者治疗后随访肿瘤标志物仍有争议, 但是 术后监测有助于评价手术完整性和早期发现肿瘤 复发。动态监测CEA 和CYFRA21-1 可反映非小细 胞肺癌(non-small cell lung cancer,NSCLC)治疗有 效或进展,NSE 和ProGRP 则用于小细胞肺癌。
肺癌血清CEA 升高率为30%~70%,腺癌升高 尤明显。CEA 单独升高对肺癌无诊断意义。某些良 性病变也可导致CEA 升高。联合CYFRA 21-1 和 SCCA能提高对NSCLC 诊断的敏感性。
CEA 能否预测化疗疗效? 一项包含了180 例 晚期NSCLC 患者的前瞻性研究结果提示,CEA 动 态变化反映NSCLC 化疗的疗效。2 周期化疗后 CEA 浓度下降≥14%预测化疗有效的敏感性为 90.2%,特异性为89.9%,不受病理类型影响,同时 其PFS 优于CEA 浓度下降<14%者(8.7 个月vs. 5.1 个月)。2 周期化疗后疾病稳定的患者CEA 浓度升高的比例为9.4%。2 周期化疗后疾病进展 的患者CEA 浓度升高的比例为87.5%(P<0.001)。 2 周期化疗后CEA 浓度升高≥18%预测肿瘤进展 的敏感性为85%,特异性为15%[ 16]。
CEA 能否预测靶向治疗的疗效? 回顾性研究 发现, 基线CEA≥5 ng / mL 的NSCLC, 吉非替尼 缓解率更高, OS 更长[ 17]。肺腺癌CEA≥5 ng / mL 与表皮生长因子受体(epidermal growth factor receptor,EGFR) 突变相关。血清CEA≥20 ng / mL 者EGFR 突变率最高[ 18]。
CEA 与早期肺癌复发。118 例早期肺癌术后的 前瞻性研究提示CEA 可以预测NSCLC 术后早期 复发[ 19]。一项包括261 例Ⅰ期NSCLC 的回顾性研 究提示肿瘤分化程度和CEA 水平是术后复发的预 测因子[ 20]。另一项包括263 例患者的回顾性研究 提示,术后CEA 水平是Ⅰ期NSCLC 术后复发独立 的预测因子。CEA 水平升高的患者可从辅助化疗 中获益[ 21]。
基于上述证据,虽然血清CEA 水平在肺癌预 后及复发预测方面有一定的价值,CEA 升高提示 转移和预后差, 但没有影像学进展而仅有CEA 水平升高时,并不能判断为疾病进展。目前也没 有证据可证明CEA 的升高程度和疾病的严重程 度的相关性, 更缺乏将CEA 等血清标志物作为 治疗决策判断因子的研究结果。美国的NCCN 指 南, 甚至都没有将包括CEA 在内的血清肿瘤标 志物推荐为随访的内容之一。因此,仅凭CEA 升 高来评估疗效、判断预后、做治疗决策并不可取。
我们的调查显示,目前几乎所有医院都在为肺 癌患者检测血清肿瘤标志物, 有8%的医生根据 CEA 升高来判断肺癌转移复发,甚至决定治疗方案 (6%)。但是专家组认为,过分依赖肺癌血清肿瘤标 志物可能导致过度诊断和过度治疗,给患者及其家 属造成不必要的焦虑和心理威胁。95%的与会专家 同意,仅有血清标志物(如CEA)的升高而没有影像 学进展的证据时,不要改变肺癌原有的治疗策略。
3 共识三: 在和患者及其家属讨论治疗获 益、潜在危害和高昂费用之前,不要给早 期肺癌术后患者、局部晚期肺癌患者进 行螺旋断层放疗(Tomo)共识级别:2B。
螺旋断层放疗(Tomotherapy,Tomo) 是近些年 出现的新型放疗技术, 可以针对病灶进行精确放 疗。Tomo 有较好的肿瘤放疗适形性和实现对正常 组织和器官的保护, 但同时有大体积的正常组织 接受了低剂量的照射, 这在肺癌的放疗中可能会 增加肺的放射性肺损伤。
大多数研究表明, 胸部肿瘤局部精确放疗的
放射性肺损伤的危险因素与肺部接受的剂量有密 切关系。例如一项关于食管癌Tomo 放疗的回顾 性研究提示V5(受到5 Gy 剂量照射的肺体积)是 一个重要的预测肺毒性因素。V5>60%的患者,急 性肺毒性明显增加[ 22]。一项接受立体定向放射 治疗(stereotactic body radiation therapy, SBRT)肺 癌患者的回顾性研究表明V5、V13、V20 是重要的 预测肺毒性因素[ 23]。
目前有关肺癌Tomo 多为小样本回顾性研究, 结果并不令人乐观。举例如下:
(1)37 例NSCLC, 中位随访时间18 个月。2 年生存率和局部控制率分别为56%和63%。≥Ⅲ 级急性损伤:食管炎5 例,肺炎7 例。治疗相关死 亡4 例。多因素分析显示,对侧肺V5 为死亡相关 原因。Tomo 虽然有较好的疗效,但增加治疗相关 性死亡[ 24]。
(2)31 例肺癌, 中位随访时间6.6 个月,2 个 月、4个月、6 个月的累积放射性肺炎的发生率分别 为13.2%、58.5%、67.0%。未见4 级以上的放射性 肺炎。单因素分析表明,同侧肺V5、V10、V15 以及 对侧肺V5 为放射性肺炎的危险因子。多因素分析 则提示同侧V10 为危险因素[ 25]。
(3)30 例不可手术肺癌患者共31 个病灶接受 Tomo 治疗。中位随访时间36.5 个月,3 年生存 率77%。其中2 例患者(6.7%)死于放射性肺炎 (5 级)。5 级肺损伤与V5(P=0.067)有关[ 26]。
(4)25 例ⅢB 或Ⅳ期肺非鳞癌患者,一线小分 子靶向治疗加用Tomo 放疗。中位随访时间30 个 月。放疗总有效率84.0%,中位PFS 为16 个月。毒 性总体耐受。需有效防止放射性肺炎,2 例死于放 射性肺损伤[ 27]。
综上,Tomo 治疗肺癌在取得比较高的有效率 的同时, 也带来了比较高的相关毒性和治疗相关 死亡。上述4 组小样本的回顾性研究,治疗相关死 亡高达6.5%(8 / 123)。与会专家建议,Ⅱ~Ⅲ期肺 癌放疗中, 首先使用三维适形放疗和调强放疗技 术,如果能使肺的剂量在耐受的范围内,就不必使 用Tomo。除非只有通过此技术才能达到的理想物 理剂量分布。三维适形放疗、调强放射治疗和Tomo 疗效是否存在差异,尚无前瞻性研究比较。
97%的与会专家认为,Tomo 在肺癌的应用目 前缺乏随机对照研究的强有力证据, 有较明显的 潜在危害而且费用昂贵,Tomo 用于胸部肿瘤治疗 需谨慎。现场调查91%的专家认为,在没有高级别 的循证医学证据之前, 不应在早期或局部晚期肺 癌中常规使用Tomo。
4 共识四:在有标准治疗方法的情况下,不 要给肺癌患者开展缺乏临床证据的所谓 新技术新疗法共识级别:1B。
针对人体试验和研究, 人类制定了一系列的 道德规范,如纽伦堡法典、赫尔辛基宣言、贝尔蒙 报告,还有一些组织如国际医学组织理事会、世界 卫生组织、联合国教科文组织和其他国际组织制 定的准则, 人类学会了如何以科学的名义对待自 己的同类。
贝尔蒙报告早在1974 年就确立了行医和科研 之间的界限,确立了涉及人类受试者的基本伦理原 则,即尊重个人、行善、公正[ 28]。《赫尔辛基宣言》 2013 版第37 条提到, 当无现存有效的治疗方法 时,若医生觉得有挽救生命、重新恢复健康或减轻 痛苦的希望,那么在取得患者知情同意的情况下医 生可以使用尚未经证实的治疗措施。这些治疗措施 应确定研究目的,设法评估安全性和疗效。新出现 的相关情况必须记录,且如有可能应予以公开[ 29]。
近些年我国在科学伦理道德规范上取得了长 足进步。我们需要关注的是第三类医疗技术,这些 技术大多缺乏随机对照研究,有伦理争议、潜在危 害不清楚,或费用昂贵,如干细胞技术、脑消融术 戒毒、变性手术、人工心脏植入、断骨增高等。我国 政府相关部门已采取措施加以规范或制止[30]。经 过热烈讨论,97%的参会专家认为, 在有标准治疗 方法的情况下, 不要给肺癌患者开展缺乏临床证 据的所谓新技术新疗法。
The authors have declared that no competing interests exist.


