一些遗传学确定的癌症依靠单一过度活跃的癌基因来增殖和生存,这种现象称之为“癌基因成瘾(oncogene addiction)”,如慢性髓细胞性白血病的 BCR-ABL融合基因,非小细胞肺癌(non-small-cell lung cancer, NSCLC)的表皮生长因子受体(epidermal growth factor receptor, EGFR)基因的活化突变和 EML4-ALK融合基因。选择性靶向这些“驱动癌基因(driver oncogene)”的新一代药物,包括酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs),治疗驱动癌基因阳性患者的疗效要显著优于传统的化疗[ 1, 2]。因此,确定具有酪氨酸激酶活性的驱动癌基因,可望有助于开发新的分子靶向治疗药物,实现癌症患者的个体化或精准治疗(precision therapy)。
原癌基因 MET编码受体酪氨酸激酶MET(或称为c-MET)。MET与其配体肝细胞生长因子(hepatocyte growth factor, HGF)结合,引起受体酪氨酸磷酸化并通过PI3K和AKT、STAT3或者RAS和MAPK激活下游信号通路。MET正常活化对于伤口愈合和胚胎发育是必需的[ 3, 4],但一部分晚期恶性肿瘤MET信号通路过度活化导致细胞增殖、分裂、迁移和侵犯等生物学行为上调[ 3, 5, 6, 7, 8, 9, 10]。虽然这种异常的MET信号通路可能来自 MET基因的遗传改变或失调[ 11],但迄今为止,还没有充分的循证医学证据显示 MET基因改变(包括多倍体、基因扩增和基因突变)可以作为潜在的治疗靶点。
临床前数据显示, MET基因扩增肺癌细胞株依赖MET通路生长和存活[ 12]。MET酪氨酸激酶抑制剂克唑替尼(Crizotinib,PF-02341066)对 MET扩增的胃癌细胞具有抗肿瘤作用[ 13],另一种MET TKI(PHA-665752)对 MET扩增型肿瘤相当敏感[ 14]。克唑替尼对体外 MET扩增的细胞株和 MET扩增的多个瘤种(胃癌、NSCLC、肾癌和前列腺癌)移植肿瘤动物模型的MET酪氨酸激酶产生抑制作用,与抑制间变淋巴瘤激酶(anaplastic lymphoma kinase, ALK)融合基因变体的酪氨酸激酶相类似[ 15]。
研究发现,克唑替尼或MET的siRNA抑制 MET扩增的NSCLC细胞MET信号通路,引起细胞凋亡,并伴随AKT和MAPK下游通路的ERK磷酸化减弱,但非激酶区域突变(外显子14的N375S或缺失突变)阳性的NSCLC细胞不出现这种现象[ 16],这些结果推测MET信号通路对维持 MET基因扩增的NSCLC细胞的生存是必需的,但对没有扩增和 MET非激酶区域突变的细胞则不然,尽管MET-TKIs对MET激酶区域突变有作用[ 17]。克唑替尼对 MET扩增的肺癌移植肿瘤模型产生了显著的抗肿瘤效应,但对 MET扩增阴性或 MET突变者没有疗效。这些研究推测,是基因扩增而不是基因突变使得 MET基因成为驱动癌基因。
因此认为, MET基因扩增可能是一种驱动基因。 MET扩增的肿瘤细胞依赖(成瘾addicted to)持续活化的MET信号通路来维持生长与存活,在体外细胞和动物体内实验中,小分子MET抑制剂或通过靶向MET mRNA 的RNA干预抑制MET信号通路可取得显著的抗肿瘤疗效。这些发现为临床使用MET-TKIs靶向治疗 MET基因扩增型肿瘤提供了理论基础。
迄今为止,个案报道显示 MET基因扩增的NSCLC、脑胶质细胞瘤及胃食管癌对克唑替尼有疗效[ 18, 19, 20, 21]。一项多中心随机对照Ⅱ期试验入组了MET免疫组化(immunohistochemistry,IHC)阳性(IHC++或+++的细胞≥50%)晚期NSCLC患者,厄洛替尼联合MET单抗Onartuzumab比厄洛替尼+安慰剂显著提高了无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)[ 22]。尽管如此,Ⅲ期试验却取得了阴性结果[ 23]。
今年ASCO年会上报告了一项在研克唑替尼治疗 MET扩增晚期NSCLC的Ⅰ期试验 (NCT00585195)的组成部分,荧光原位杂交法(fluorescence in situ hybridization,FISH)确诊为 MET扩增的晚期NSCLC 患者分为三类:1.8≤MET/CEP7 比值≤2.2 (低度扩增), 2.2<MET/CEP7比值<5 (中度扩增)和MET/CEP 7比值≥5 (高度扩增)。 MET扩增在NSCLC人群中的发生率为7.4%(59/800),其中低、中、高度扩增患者的比例分别为3.6%(29/800)、3.0%(24/800)和0.8%(6/800)。 MET扩增患者接受克唑替尼治疗的剂量为250 mg每天二次口服。采用RECIST1.0标准评价肿瘤客观疗效。结果显示,低、中、高度扩增患者的有效率分别为0%(0/2)、17%(1/6)和67%(4/6)。常见的不良事件包括腹泻(50%)、恶心(31%)、呕吐(31%)、周围性水肿(25%)和视觉障碍(25%),大多数不良事件为1度。本研究仍在继续入组中。研究者认为, MET扩增疾病可能代表了一种新治疗靶点的NSCLC分子亚型,尤其见于吸烟者;克唑替尼治疗中、高度 MET扩增NSCLC患者取得了临床疗效;克唑替尼250 mg每天二次的耐受性良好且不良事件可以处理;这些发现支持对 MET扩增NSCLC患者接受克唑替尼治疗的深入研究。探索MET/CEP7 最佳比值与克唑替尼临床获益相关性的研究正在进行中[ 24]。
另一项高度选择的MET口服抑制剂AMG337首次治疗成人晚期实体瘤的Ⅰ期研究(NCT01253707)也在今年ASCO年会获得了口头报告的机会。该研究评价了AMG337的耐受性、安全性、药代动力学和肿瘤客观疗效。MET过表达/扩增/突变的患者可以入组。至2013年10月,接受各个剂量组的患者共66人,可供肿瘤疗效评价(中心实验室数据)者45人: 1例完全缓解(complete response,CR),4例部分缓解(partial response,PR),28例疾病稳定(stable disease,SD),12例疾病进展(progressive disease,PD)。8例 MET扩增的患者中,7例是胃食管癌(1例CR,4例PR,1例SD,1例PD),另1例是肾细胞癌(PD)。研究者认为,AMG337治疗 MET扩增亚型的晚期肿瘤患者可取得客观肿瘤疗效,最大耐受剂量300 mg 每天一次时扩大入组至50例患者[ 25]。
在今年ASCO年会报告的最后一项治疗MET阳性晚期实体瘤患者的Ⅰ期临床试验中,对于EGFR野生型NSCLC患者,如果MET IHC阳性但FISH阴性,则使用MET(TKI-INC280)无效,但FISH阳性则有效(2例),另1例FISH状态未知也有效,INC280 600 mg (每天二次)扩大队列中,EGFR野生型/MET阳性NSCLC患者的客观疗效见 图1。因此,FISH阳性更重要,但IHC阳性可作为筛查手段[ 26]。
| 表1 MET扩增肿瘤靶向治疗的疗效 |
表1总结了MET阳性晚期恶性实体瘤患者接受MET单抗或MET-TKIs治疗的客观疗效和生存期。由此可见,更多的证据支持 MET基因扩增的患者可能从相应的MET -TKI靶向治疗中获益,从基因扩增的角度看, MET基因是一种驱动基因,存在于NSCLC、胃肠道和其他晚期实体瘤。初步的证据似乎孕育着 MET基因扩增型肿瘤“METoma”的新概念。
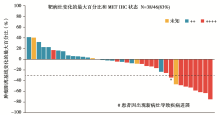
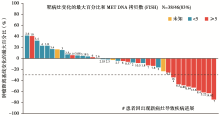
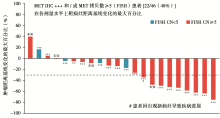
今年ASCO年会报道了吴一龙教授的一项吉非替尼联合INC280治疗 EGFR突变并MET阳性耐药晚期NSCLC患者的Ⅰb/Ⅱ期试验[ 27]。IHC+++相对于IHC++的患者来说,显著提高了客观疗效或疾病控制率,见 图2。MET FISH拷贝数大于5的患者,比起拷贝数小于5的患者,显著地提高了疗效,见 图3。由此可见,MET IHC或FISH单一指标预测疗效,不如两者结合起来更有功效,见 图 4。
从循证医学来看,目前 MET基因扩增型肿瘤“METoma”只有3项Ⅰ期临床试验的证据,而 MET基因扩增引起耐药的晚期 EGFR突变NSCLC仅有1 项Ⅰ期试验,因此,我们需要Ⅱ、Ⅲ期临床试验更高级别的证据。
何者是最佳的预后预测因子?
对于 MET基因扩增型肿瘤“METoma”来说,在基因扩增、IHC和基因突变三个标志物中,基因扩增似乎证据比较多。但在Ⅱ期Onartuzumab试验中,MET IHC对PFS和OS有预测作用[ 28]。所以,IHC和基因突变的地位仍需要更多的探索。
对于 MET基因扩增引起耐药的晚期 EGFR突变NSCLC,MET IHC或FISH扩增单一指标预测疗效,不如两者结合起来更有功效[ 27],但 MET突变不太清楚。尽管Ⅱ/Ⅲ期试验MET IHC阳性NSCLC接受EGFR TKI+MET Mab是失败的,但对于 EGFR突变患者耐药后出现IHC阳性的患者,这种联合用药模式可否克服耐药性?
此外,HGF的作用也没有论及。
目前在 MET扩增的晚期肿瘤使用口服小分子MET-TKIs可以取得不错的客观疗效,但 MET扩增的肿瘤发生率比较低(如NSCLC、胃肠道肿瘤等),能否把MET IHC+++作为靶点挖掘更多的人群接受个体化的靶向治疗?
尽管如此, MET基因扩增型肿瘤和 MET基因扩增引起耐药的晚期 EGFR突变NSCLC的Ⅱ期临床试验已经在全球启动了,更可喜的是,除 MET基因扩增这个标志物外,HGF、MET IHC和 MET基因突变也纳入了探索性研究目标。中国的肺癌学者在上述两个研究领域也将发挥重要的作用。
临床前数据、Ⅰ期临床试验和个案报道显示, MET基因扩增的晚期恶性实体瘤(NSCLC、胃食管癌、结直肠癌和脑胶质瘤等),对口服小分子化合物MET-TKIs如克唑替尼、INC280和AMG337等,初显不错的客观疗效,毒性可以接受,但仍需要Ⅱ/Ⅲ期临床试验级别更高的证据,我们有信心迎接“METoma”时代的到来。此外,Ⅰ期试验提示,联合EGFR和MET两种TKI可以克服晚期 EGFR突变型NSCLC患者 MET基因扩增引起的耐药性,同样期待Ⅱ/Ⅲ期试验结果。尽管如此,最佳生物标志物的探索也日显迫切。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|