| 陆舜教授,临床医学博士,主任医师,博士研究生导 师。上海市肺部肿瘤临床医学中心主任。目前参加和承 担国家和上海市科研基金项目8 项。其中国家级课题 为:2007 年和2012 年均作为第一负责人承担国家863 重大课题“肺癌的分子分型和个体化诊疗” 的子课题; 2007 年参与承担国家十一五科技支撑计划课题,2012 年作为第一负责人承担科技部国际合作课题“中瑞合作 肺癌临床医学中心肺癌诊治关键技术转化医学研究”。 还承担上海市科委课题3 项,上海市卫生局申康医院发 展中心课题2 项。至2012 年作为主要研究者参与或承 担20 余项国际国内多中心随机对照临床研究。 2010 年获得上海市医学领军人才。2013 年获得上 海市优秀学术带头人称号。2013 年作为第一负责人获得上海市医学科技奖三等奖。作为第一作者发表论 文及论著80 余篇,其中SCI 收录22 篇包括Chest、JTO、Plos One 等知名杂志。参加多项专著的编写工作。 国际学术任职:美国临床肿瘤学会(ASCO)国际事务部委员,多学科诊治小组(MCMC)成员,国际肺癌 研究协会官方杂志Journal of Thoracic Oncology 副主编, The Oncologist 杂志编委。国内学术任职:中国抗 癌协会肺癌专业委员会候任主任委员、国家食品药品监督管理局新药评审专家、中华医学会肿瘤学会委 员、内科专家组成员、中国抗癌协会临床肿瘤协作专业委员会(CSCO)副秘书长兼常委,中国老年肿瘤协 会委员、中国抗癌协会姑息治疗委员会委员、卫生部规范化用药专家委员会肿瘤药物组成员、卫生部肺癌 临床路径专家组成员、国家自然基金委专家组成员、上海市医学会肿瘤学会候任主任委员、上海市抗癌协 会理事、上海市医学会肿瘤靶分子学会委员等,并且是上海市医学类高级职称内Ⅱ组评审委员、上海市干 部保健专家库成员、上海市医学会医疗事故技术鉴定专家库成员、上海市化疗质控中心委员、上海市控烟 协会理事、上海市青联委员等。 |
Koeppen H, Yu W, Zha JP, et al. Biomarker analyses from a placebo⁃controlled phase Ⅱ study evaluating Erlotinib ± Onartuzumab in advanced non⁃small⁃cell lung cancer: MET expression levels are predictive of patient benefit[J]. Clin Cancer Res, 2014, Mar 31 [Epub ahead of print]. DOI: 10.1158/1078⁃0432.CCR⁃13⁃1836.
2b。
•MET是与肝细胞生长因子(hepatocyte growth factor,HGF)结合的酪氨酸激酶受体,它在人类的多种恶性肿瘤中都存在过度表达。MET的激活常见于肿瘤基因,且其信号通路通常受到多种机制的调节。MET的蛋白质表达水平、突变及扩增均提示与非小细胞肺癌(non-small cell lung cancer,NSCLC)的预后相关。
•MET单抗(Onartuzumab)是一种针对 MET的重组人类单克隆抗体。一个在NSCLC患者二/三线治疗的Ⅱ期临床试验(OAM4558g)对比了MET单抗 + 厄洛替尼vs. 安慰剂 + 厄洛替尼。研究者用免疫组化法(immunological histological chemistry,IHC)检测了患者肿瘤组织中的MET表达水平,并划分为MET阴性组与MET阳性组。在MET的IHC分组中,接受了MET单抗 + 厄洛替尼治疗的患者无进展生存时间(progression-free survival,PFS)与总生存时间(overall survival,OS)都有所延长。
•应用何种方法检测何种基因,才可以更好地预测MET单抗的疗效,尚需进一步证实。
通过IHC检测MET阳性的NSCLC患者在经过MET单抗 + 厄洛替尼治疗后疗效更佳,阐述MET IHC分析法的发展成熟过程,并回顾性分析多个用于预测预后的肿瘤标志物在NSCLC中的作用。
•研究条件:由美国南旧金山的基因科技有限公司资助。
•研究起止时间:2009年3月至2010年8月。
•研究方法:前瞻性,随机,双盲,多中心Ⅱ期临床试验。
•研究对象:年龄>18岁的ⅢB期/Ⅳ期NSCLC患者,既往经过二线治疗。PS评分≤2分。有可用的肿瘤组织标本。在任何研究性筛查项目之前签署知情同意书。
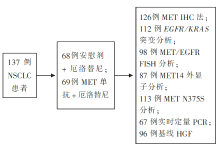
•干预措施:研究共纳入137名患者,随机分为两组。68人接受安慰剂 + 厄洛替尼,69人接受MET单抗 + 厄洛替尼。用不同的检测方法检测患者的MET水平并分析MET水平与预后的相关性,研究流程见 图1。
•评价指标:PFS,OS,MET的IHC水平。
•在NSCLC细胞系/组织中,IHC法、蛋白质印迹法与MET的mRNA表达有关。在这个Ⅱ期临床研究中,MET的IHC分析法采用了百分比与临界值(染色强度10%、50%及90%)。
•进一步研究提示使用MET单抗 + 厄洛替尼延长OS与 MET基因的高拷贝数(FISH法测得拷贝数≥5)不相关(风险比1.27, P=0.068;中位OS 6.8 个月vs 9.1个月),但与IHC法阳性有关(风险比0.37, P=0.01)。
•MET、EGFR、双调蛋白、表皮调节因子以及HGF的mRNA表达无法预测MET单抗的疗效;MET的mRNA水平也与OS的延长无关(风险比0.59, P=0.23)。
•基线血浆HGF浓度较低的患者在MET单抗治疗中对于OS的风险比是0.519( P=0.09)。
经过多种方法的探索实践认为,以IHC法测得的MET表达水平是对于接受MET单抗+厄洛替尼治疗患者的最佳预后预测因素。
MET受体编码基因 MET是一个新的不同于已知癌基因RAS家族的转化基因。分子生物学和生物化学实验证实HGF为MET配体。MET是目前唯一已知的HGF受体。HGF与MET在浆膜上的结合可激活下游信号级联反应,首先使胞质酪氨酸激酶磷酸化,继而导致MET的自身磷酸化。
Onartuzumab(OA-5D5、 OAM4558g、 METMAb)是大肠杆菌衍生物,人源化抗MET单克隆抗体。传统的二价抗体可通过激活(而不是抑制)MET信号诱导MET二聚化作用。相比之下,Onartuzumab则抑制HGF结合而非诱导MET二聚化作用。此前进行的安慰剂对照Ⅱ期临床试验(OAM4558g)显示,厄洛替尼 + Onartuzumab与厄洛替尼相比较,联合用药对于MET阳性的NSCLC患者能够延长PFS[ 1]。
本文的作者试图对OAM4558g研究中的样本进行分析,以进一步了解不同的分子标记的表达对于Onartuzumab的治疗效果是否有预测作用,并为是否可能开展随后的临床研究寻找依据。
该研究得出了以下结果:
(1)从16种抗体中,验证挑选出敏感性和特异性最佳的SP44单克隆抗体,进行后续免疫组化检测。对组织标本的SP44表达情况行免疫组化检测及半定量统计分析,根据SP44表达的范围和强度分为:阴性(0),弱阳性(+),阳性(++),强阳性(+++)。这种临床评分系统通过H-评分系统验证,敏感性及特异性良好。
(2)确定MET 免疫组化检测的最佳分界点值。有文献报道肿瘤细胞MET染色(++~+++)>10%或者>90%(++~+++)与患者预后没有良好的相关性。本研究通过PFS及OS对不同的分界点(染色强度10%、50%及90%)进行了更为细致的比较,发现染色强度50%是最佳的分界点。
(3)在NSCLC细胞和组织标本中,MET mRNA、蛋白及IHC的表达均成正相关。在Ⅱ期临床试验中,通过IHC检测MET表达的范围和强度进行临床评分,发现MET的表达水平可以很好地判断预后。进一步分析发现:MET高拷贝数(FISH检测均值≥5个拷贝/细胞)的 Onartuzumab+厄洛替尼患者,OS提高,但差异无统计学意义。然而,在MET IHC阳性/MET FISH阴性患者,这种优势亦存在,OS提高(风险比0.37, P=0.01)。
(4)MET、EGFR、Amphiregulin、Epiregulin或HGF mRNA的表达水平并不能预测服用厄洛替尼患者的预后,在高表达肿瘤MET mRNA水平的患者,OS有所改善,但差异无统计学意义(风险比0.59, P=0.23)。厄洛替尼治疗更适用于血浆HGF低表达的患者,OS的风险比为0.519( P=0.09)。
因此作者最后得出结论:与所有可能的预后指标相比,MET IHC染色是最好的可用于预测接受Onartuzumab +厄洛替尼治疗患者的OS和PFS的预后指标。
基于一个Ⅱ期临床研究结果得出如此的结论,就研究本身而言无可厚非,然而Ⅱ期临床研究受到病例数的局限,很多结论需要进一步的Ⅲ期临床研究验证,才能证明其研究结论的可靠性。而事实上,随后的Ⅲ期临床研究结果在今年已经产生,这是一个让人失望的结果,中期分析计划在达到最终病例数的67%(即244例)时进行。增加Onartuzumab后,厄洛替尼联合用药组并未显现OS有所改善(风险比1.27, P=0.068;中位OS 6.8个月vs. 9.1个月),也未能改善 PFS (风险比0.99, P=0.92 ,中位PFS 2.7个月vs. 2.6个月)或总缓解率(8.4% vs. 9.6%, P=0.63),2014年3月3日,罗氏公司宣布,因缺乏临床意义的有效性,独立数据监测委员会建议终止Onartuzumab+厄洛替尼二线或三线治疗MET阳性晚期NSCLC的Ⅲ期METLung 研究。
因此到目前为止,我们并没有找到合适的MET抑制剂来治疗MET阳性的NSCLC患者。但是对于这样一系列临床研究,我们也需要进一步分析失败的内在原因:首先,MET阳性的判断标准是什么?在前面的临床研究中,主要应用了IHC法,这种方法是否为标准方法,还有没有更好的检测方法?其次,使用Onartuzumab是否一定要联合厄洛替尼,本研究纳入的都是EGFR野生型的患者,所以在本研究中厄洛替尼几乎不发挥治疗作用,因此对于MET阳性的患者,是否可能有MET抑制剂联合其他治疗手段的方案?这些都是值得我们进一步研究的关注点。
| [1] |
|