|
周建英,浙江大学医学院附属第一医院呼吸内科主任,肺部疾 病诊疗中心主任,教授,博士生导师,主任医师,浙江大学医学院呼 吸病学教研室主任。中华医学会呼吸病学会常委,浙江省医学会呼 吸病分会主任委员,浙江省抗癌协会肺癌专业组副主任委员,浙江 大学呼吸病研究所副所长。参与《中国肺癌ALK 基因检测专家共 识》的起草工作。近年以主要研究者身份参加多项肺癌国际及国内 多中心临床试验, 如克唑替尼的A8081029 一线临床试验,LDK378 的Ⅰ / Ⅱ期临床试验, Dacomitinib 的ARCHER 1050 试验,吉非替 尼的IMPRESS、INFORM 试验、C-TALK、IGNITE 等项目,担任中华 呼吸和结核杂志、Chest 中文版、Annals of Oncology 肺癌分册中文 版编委。 长期扎根一线临床、教学、科研工作30 余年,研究方向为肺癌 早期诊断、个体化治疗及生物靶向治疗,指导博士、硕士研究生50 余名。承担国家自然科学基金及省科技厅重大科研项目等共10 多项,发表论文130 余篇,包括在 J Immunol、Chest、Cancer Letters、Lung Cancer 等杂志发表SCI 收录论文30 余篇, 获浙江省科技进步二等 奖三次。曾获“中国医师奖”、“中国呼吸医师奖”、“全国三八红旗手”等称号。 |
研究一: Zou HY, Li Q. An orally available small-molecule inhibitor of c-Met, PF-2341066, exhibits cytoreductive antitumor efficacy through antiproliferative and antiangiogenic mechanisms [J]. Cancer Res, 2007,67(9):4408-4417.
研究二:Tanizaki J, Okamoto I. MET tyrosine kinase inhibitor Crizotinib (PF-02341066) shows differential antitumor effects in non-small cell lung cancer according to MET alterations [J]. J Thorac Oncol, 2011,6(10):1624-1631.
5。
研究一:近年来,大量研究显示很多人类恶性肿瘤与肝细胞生长因子(hepatocyte growth factor,HGF)/MET信号通路的异常调节相关,针对HGF/MET的靶点抑制剂成为实体瘤靶向治疗领域的热点。克唑替尼(Crizotinib,PF-02341066)是一种强效、口服ATP竞争性小分子MET激酶抑制剂,可以作为MET依赖的实体瘤治疗的新靶向药物。
研究二:针对MET靶点的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)已经进入实体瘤的临床试验阶段,但预测MET-TKI疗效的生物标志物仍未明确。寻找克唑替尼针对MET的作用靶点,可以帮助临床选择最佳获益患者,真正实现靶向药物的精准治疗。
研究一:通过体内外实验明确克唑替尼的药理学特性、抗肿瘤效应和生物学安全性,从而为克唑替尼针对MET靶点的临床应用提供理论背景。
研究二:在 MET扩增、突变和野生型的肺癌细胞株上分别验证克唑替尼的抗肿瘤效应,寻找其抑制MET受体酪氨酸激酶的作用靶点。
•研究二:
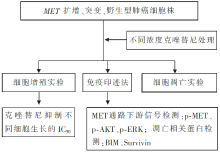
(1)细胞体外实验:克唑替尼处理 MET扩增、突变、野生型肺癌细胞株,寻找药物抑制各类细胞生长的IC50 值,同时研究药物处理后下游信号分子的变化,流程见图3。
(2)克唑替尼对 MET扩增肺癌细胞株的抑制作用及其作用机制验证:
•MET siRNA分别转染 MET扩增和突变的肺癌细胞株;
•BIM上调和Survivin下调的功能验证:在 MET扩增肺癌细胞株中分别转染BIM siRNA、Survivin 表达载体。
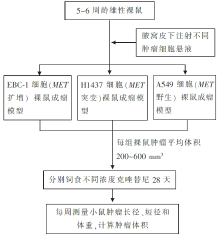
(3)克唑替尼动物体内抗肿瘤实验流程见 图4。
研究一:
(1)细胞体外实验
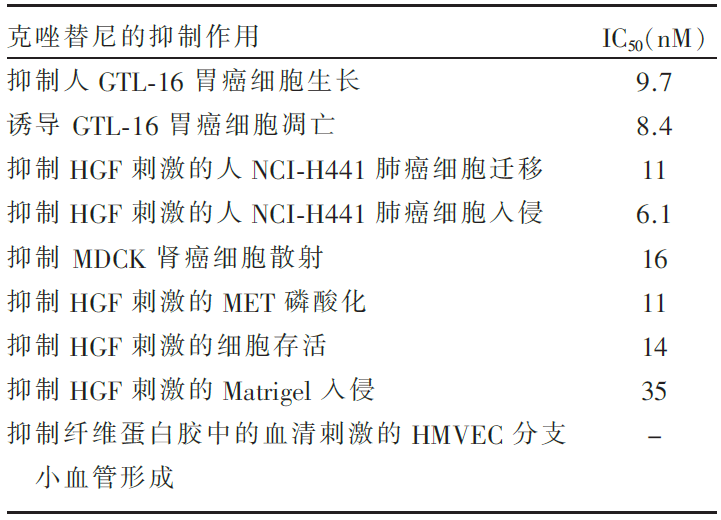
克唑替尼抑制肿瘤细胞作用的IC50值见 表1。
| 表1 研究一中克唑替尼抑制肿瘤细胞作用的IC50值 |
(2)动物体内实验
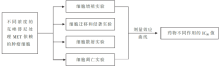
给MET依赖的移植瘤小鼠口服不同剂量的克唑替尼[3.125 mg/(kg·d),6.25 mg/(kg·d),12.5 mg/(kg·d),25 mg/(kg·d),50 mg/(kg·d)]来检测其体内抗肿瘤的疗效。
50 mg/(kg·d)剂量时,抑制100%肿瘤生长对应MET磷酸化的完全抑制;
12.5 mg/(kg·d)剂量时,抑制60%肿瘤生长对应80%~90%(1~8 h)的MET磷酸化抑制,在16~24 h后降低到50%~60%;
6.25 mg/(kg·d)剂量时,没有显著的肿瘤生长抑制作用,在1~8 h时抑制MET磷酸化30%~50%。
研究二:
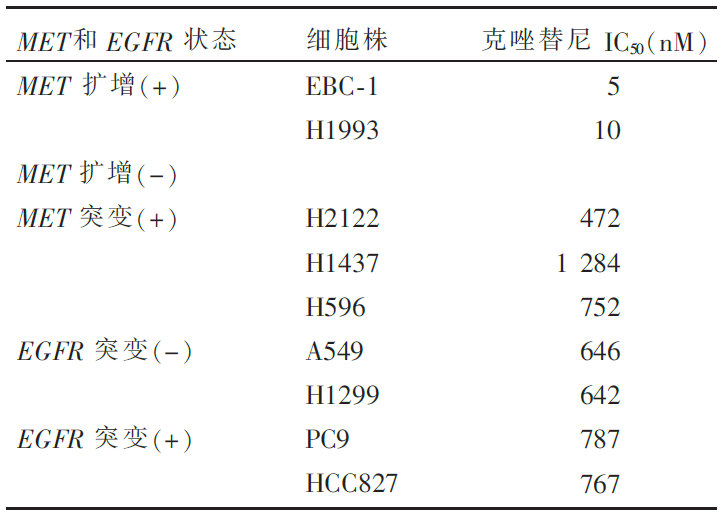
(1)细胞体外实验:克唑替尼能明显抑制 MET扩增阳性细胞的生长,见表2。
| 表2 克唑替尼体外抑制不同肺癌细胞生长的IC50值 |
(2)克唑替尼显著降低 MET扩增阳性细胞下游信号分子p-AKT、p-ERK表达水平。
(3)克唑替尼引起 MET扩增阳性细胞的大量凋亡,而 MET扩增阴性细胞不受影响。
(4)转染MET siRNA, MET扩增阳性细胞下游信号分子p-AKT、p-ERK表达水平显著降低,而 MET突变细胞下游信号分子不受影响。
(5)克唑替尼引起 MET扩增阳性细胞凋亡依靠BIM的上调和Survivin的下调。
(6)动物体内抗瘤实验。
种植EBC-1细胞( MET扩增阳性)的成瘤鼠,25 mg/(kg·d)、50 mg/(kg·d)剂量处理,均可引起肿瘤体积缩小,药物未引起明显毒副反应和体重减轻。
种植H1437细胞( MET突变)和A549细胞( MET野生型)的成瘤鼠,50 mg/(kg·d)剂量处理也未见肿瘤体积缩小。
研究一:克唑替尼可以直接抑制MET依赖的肿瘤细胞的生长,还可以抑制肿瘤血管生成;克唑替尼作用于MET依赖的移植瘤小鼠,有良好的抗肿瘤疗效。
研究二:克唑替尼能显著抑制 MET扩增的肺癌细胞生长,但是对 MET扩增阴性即使有 MET突变的肿瘤细胞也无抑制作用。
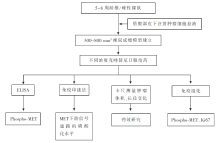
晚期非小细胞肺癌的治疗已进入个体化靶向治疗时代。针对MET的靶向抑制治疗是目前肺癌个体化诊疗的新热点。MET的小分子抑制剂,如SU11274和PHA-665752,虽然在体外和体内研究中有明确的抗癌作用,但是由于药学特性和口服用药的生物利用度差,临床应用受限[ 1]。 目前研究认为新型小分子MET抑制剂克唑替尼、AMG337、INC280具有良好的临床耐受性,开启了针对MET信号通路的小分子抑制剂的新纪元。
文献一发现在体外研究中,克唑替尼对MET酪氨酸激酶有很强的选择性抑制作用,可抑制多种肿瘤细胞的增殖、迁移和侵袭,且有效地抑制HGF刺激的内皮细胞的生长、侵袭和血清诱发的血管形成。为探讨 MET基因不同位点的点突变是否会影响克唑替尼对MET酪氨酸激酶活性的抑制效果,作者采用ELISA方法,发现克唑替尼对存在ATP结合区、P-环区和近膜区 MET基因突变细胞的MET磷酸化的抑制作用与野生型相似或有增强,而对包含活化环区的Y1230C和Y1235D突变的细胞对比野生型细胞的抑制率显著降低。作者进一步验证克唑替尼对裸鼠皮下移植瘤成瘤能力的影响,发现克唑替尼能显著抑制因 MET基因扩增,或同时自分泌HGF和表达MET导致的 MET呈激活状态的肿瘤细胞所建立的移植瘤的生长,其抑制效果与MET磷酸化的抑制程度直接相关。在存在旁分泌HGF(间质细胞产生)条件下,克唑替尼亦可抑制无 MET基因扩增和不能自分泌HGF的NCI-H441肺腺癌细胞建立的移植瘤的生长。但是同样的条件下,对无 MET基因扩增和不能自分泌HGF的MDA-MB-231乳腺癌细胞和DLD-1直肠癌细胞,克唑替尼并不能有效抑制肿瘤的生长,其中的分子机制未明确。
文献二以 MET基因扩增的非小细胞细胞株EBC-1和H1993、 MET基因突变的H2122、H1437和H596细胞株、 EGFR基因突变的PC9和HCC827细胞株以及无基因扩增或突变的A549和H1299细胞株为研究对象。作者发现克唑替尼可显著抑制 MET基因扩增非小细胞肺癌细胞的增殖、诱导凋亡和抑制体内移植瘤的生长。但是,克唑替尼对配体结合区和膜旁区 MET基因点突变的细胞、 EGFR突变细胞、无 MET基因扩增和突变的细胞均无明显抑制作用。
我们可以看到两文献均为最早探索小分子MET酪氨酸激酶抑制剂克唑替尼对恶性肿瘤细胞作用的临床前研究佳作,从原癌基因 MET在多种恶性肿瘤中异常激活的临床现象出发,提出假说,通过多种技术手段,从不同的研究层面探讨了克唑替尼的抑癌作用。两篇文献均提示克唑替尼对 MET基因扩增的恶性肿瘤细胞有显著的抑制作用。Okamoto等在胃癌中也证实了这一结论[ 2]。文献一又从内皮细胞角度发现了克唑替尼的抗血管生成功能。还从HGF角度发现,HGF是MET目前已知的唯一配体,HGF通过与MET结合,进而活化MET,从而发挥一系列生物学特性[ 3]。从配体角度出发,发现自分泌HGF或旁分泌HGF的恶性肿瘤细胞对克唑替尼有不同的反应。此外,两篇文献都对 MET基因点突变是否影响克唑替尼的效果进行了探讨,但是,两篇文献关注角度不同,文献一是从影响MET酪氨酸激酶磷酸化的角度,文献二是从细胞增殖、凋亡等功能学的角度,两个角度有各自的侧重点和说服力。两篇文献对所涉及的问题从多角度、多层面进行细致入微的分析,反复验证,严谨周到,值得我们借鉴和学习。虽然还有复杂的分子机制尚未明确,相信遵循这种研究方法,不久的将来能进一步明确其分子机制。
两篇文献对MET抑制剂用于存在 MET基因扩增的晚期肺癌的治疗提供了理论和实验依据,提示其潜在的临床应用前景。此后,在Ou等的研究中报道了1例 MET基因扩增的非小细胞肺癌患者,无间变淋巴瘤激酶( ALK)基因的重排,口服克唑替尼治疗效果迅速且持久,服用1周时症状明显缓解,8周时(按照RECIST标准)病灶缩小45.2%, 11个月缩小54.8%。副作用轻,表现为Ⅰ级无症状窦性心动过缓和Ⅰ级视力障碍[ 4]。Ou等的研究为两篇文献提供了临床验证支持。2014年ASCO上报道了克唑替尼治疗 MET扩增晚期非小细胞肺癌的疗效和安全性的Ⅰ期试验(NCT00585195),该研究结果显示在高、中度 MET扩增患者,克唑替尼的有效率为41.7%[ 5]。目前,克唑替尼用于MET异常表达的恶性肿瘤患者已进入Ⅱ期临床试验(NCT02034981)。 MET基因扩增在非小细胞肺癌中约仅占5%[ 6, 7],能否发现更多预测MET抑制剂有效性的分子标记以及能否进一步提高克唑替尼的临床效果,我们期待更多的深入研究数据。
此外,Engelman等发现约20.9%的吉非替尼继发耐药非小细胞肺癌组织中可检测到 MET基因扩增[ 8]。文献一还提示同时自分泌HGF和表达MET蛋白的肿瘤组织和部分旁分泌HGF的组织对克唑替尼的治疗可能获益。在我们实验室的研究中,发现克唑替尼可以逆转HGF诱发的 EGFR突变非小细胞肺癌细胞对吉非替尼的继发耐药[ 9],但这些研究需要进一步的临床数据支持。
从基础研究转化到临床试验,是一个鼓舞人心的过程,正是因为有这些优秀的转化研究,人类在肺癌面前才不再束手无策,而是无所畏惧地直面挑战,进而取得更大的突破。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|