|
胡成平,中南大学湘雅医院呼吸内科教授、博士研究生导师、一 级主任医师、首届湘雅名医,中南大学湘雅医院呼吸内科主任、湖南 省呼吸内科医疗质量控制中心主任、湖南省呼吸疾病临床医疗技术 研究中心主任、湖南省支气管哮喘研究中心主任。 参与十二五国家科技支撑计划项目:慢性阻塞性肺疾病与肺癌协 同创新临床研究。参与国家973 课题:呼吸系统疾病与损伤基础研究。 先后承担国家自然科学基金、省自然科学基金资助项目27 项。发表论 文283 篇,出版专著36 部。参与《诊断性可弯曲支气管镜应用指南》, 《中国肺癌防治指南》等12 项指南及专家共识的制定和修订。 兼任湖南省医学会呼吸病学专业委员会主任委员,湖南省抗癌 协会肺癌专业委员会主任委员等多种社会职务。中国医师协会呼吸 医师分会常务委员,中华医学会呼吸分会委员,中国抗癌协会肺癌 专业委员会委员,中华医学会呼吸病学分会肺癌学组副组长,中国 医师协会内镜医师分会呼吸内镜与微创专业委员会副主席,中国支 气管病及介入肺脏病学会副主任委员,卫生部呼吸内镜诊疗技术专 家组专家。《中华结核与呼吸杂志》、《中华医学杂志(英文版)》、《Cancer Investigation》、《Lung》、《Chest》 中文版等多种杂志的常务编委、编委。 |
研究一: Qiao H, Hung W, Tremblay E, et al. Constitutive activation of met kinase in non⁃small⁃cell lung carcinomas correlates with anchorage⁃independent cell survival[J]. J Cell Biochem, 2002,86(4):665-677.
研究二:Nakamura Y, Matsubara D, Goto A, et al. Constitutive activation of c⁃Met is correlated with c⁃Met overexpression and dependent on cell⁃matrix adhesion in lung adenocarcinoma cell lines[J]. Cancer Sci, 2008,99(1):14-22.
5。
研究一:肝细胞生长因子(hepatocyte growth factor,HGF)高水平的异位表达能增强HGF/MET信号强度及致瘤性。然而在某些肿瘤中MET过表达可以引起自我激活而不依赖于自分泌机制,所以HGF自分泌的活性和HGF/MET激活状态在非小细胞肺癌(non⁃small cell lung cancer, NSCLC)中如何发生仍不得而知。
研究二:关于MET激酶活性的许多机制已经得到认可。仅用组织切片尚不能明确MET的激活机制,需要通过相关细胞系研究来证明。
研究一:评价NSCLC中HGF/MET信号通路的作用。
研究二:探讨肺腺癌细胞系中MET的内在激活机制。
•研究条件:
研究一:美国加利福尼亚州圣何塞市圣克鲁兹生物工程系,霍普金顿国际生物工程埃里克萨佛部门,旧金山基因技术和皇后大学参与。
研究二:美国苗种保藏中心,日本大阪肿瘤研究资源库、筑波理研细胞库、东京国家肿瘤中心研究所参与。
•研究方法:
研究一:RT-PCR分析,条件培养基和铜(Ⅱ)亲和色谱分析法,免疫沉淀反应和蛋白印迹法,MET激酶实验,关于HGF活性的MET激活作用实验,MDCK分散实验。
研究二:蛋白印迹法,DNA测序,单核苷酸多态性阵列分析,寡核苷酸探针微阵列分析,分散测定实验,抑制癌细胞系细胞-基质粘附实验。
•研究对象:
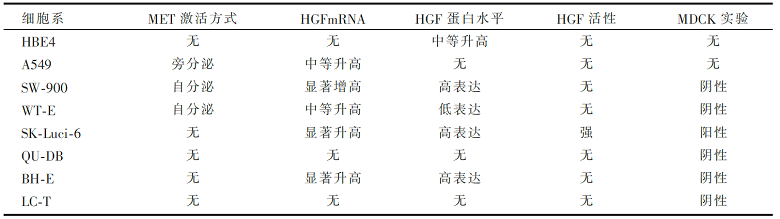
研究一:来自于肺腺癌患者的7个细胞系如下:2个原发腺癌细胞系:LCT、A549;2个原发未分化大细胞癌细胞系:QU-DB、SK-Luci-6;1个原发鳞癌细胞系:SW-900;1个鳞癌胸水细胞系:WT-E;1个腺癌胸水细胞系:BH-E;1个作为阳性对照的成纤维细胞系:HEL-299;人非恶性支气管上皮细胞细胞系:HBE4。
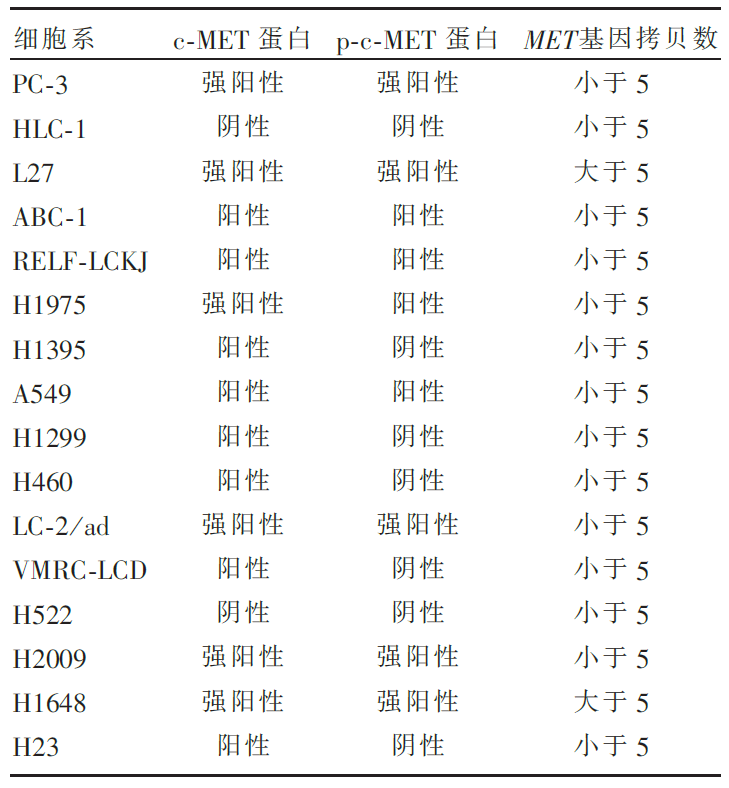
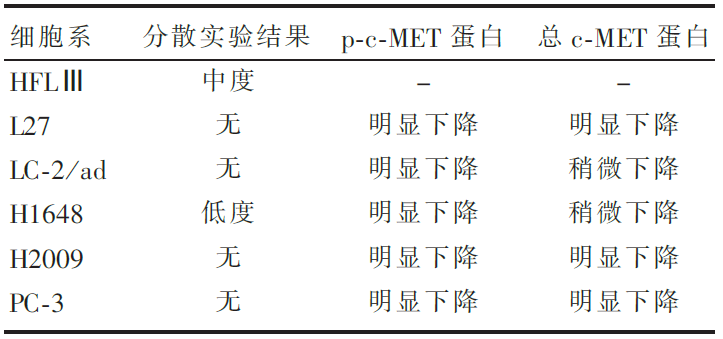
研究二:肺腺癌细胞系:H23,H522,H1395,H1648,H1975,H2009,A549,ABC-1,PC3,VMRC-LCD,HLC-1,LC-2/ad,RERF-LC-KJ,L27;大细胞癌细胞系:H460;NSCLC细胞系:H1299;肺胎儿成纤维细胞系:HFLⅢ。
•干预措施:
研究一:细胞系常规生长在RPMI-1640培养液,7%PBS增补;DMEM培养液。提取肺癌细胞系的总DNA,利用反转录产生cDNA,检测HGFmRNA和蛋白的表达水平。
研究二:癌细胞系生长于RPMI-1640培养液,HFLⅢ生长在杜佰克改良培养基中,培养基中含10%小牛血清、谷氨酰胺和抗生素,环境条件要求是5% CO2和95%空气。
•评价指标:
研究一: 内分泌和旁分泌MET活性能否提高NSCLC患者生存和促进有丝分裂。
研究二: MET内在激活是否与MET过表达有关,无论有无 MET扩增;有无配体依赖性;是否依赖于细胞-基质的粘附作用。
研究一的主要结果见 表1,研究二的主要结果见 表2至 表4。
| 表1 各细胞系的HGFmRNA和蛋白表达情况 |
| 表2 c-MET蛋白和p-c-MET蛋白表达水平及 MET基因拷贝数 |
| 表3 条件培养基中的癌细胞系的HGF蛋白印迹分析 |
| 表4 MDCK分散实验和抑制细胞-基质粘附作用 |
研究一:在NSCLC进展中,MET自分泌和旁分泌的信号通路互补,活性可能分别使生存获益或促进细胞增殖。
研究二:MET激酶的内在活性与MET过表达、细胞-基质的粘附作用相关,而与 MET基因扩增及HGF无关。
MET表达、结构异常与多种人类肿瘤的发生、发展密切相关。研究表明 MET基因是NSCLC的预后因素之一, MET基因高表达则预后不佳[ 1]。 MET基因的激活也是NSCLC患者对表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)耐药的原因之一。不同类型的肿瘤细胞和组织中,MET激活的方式不同。因此,深入了解肺癌中 MET基因的激活机制有重要的临床意义。
研究发现约72% 的肺癌组织表达MET, 其中有40% 存在过表达,且其活化形式p-MET 在肺癌中表达最高[ 2]。16种肺癌细胞株中有12/14种肺腺癌细胞株、1株大细胞肺癌和1株NSCLC中有 MET基因过表达。 MET基因扩增也是导致MET激活的机制之一,其发生率为2%~20%[ 3]。Bean等发现吉非替尼或厄洛替尼耐药的肺腺癌患者中,有21%的患者存在 MET基因扩增。而另一项研究表明,在吉非替尼耐药的NSCLC 患者中有22% 的病例发现了 MET基因扩增。提示 MET扩增可能与EGFR-TKI耐药相关。
在肺癌中 MET基因突变大多存在于配体结合的sema 区和具有负调节活性的JM 区。有报道称 sema区发生的N375S 的突变易发生于鳞癌和男性吸烟患者。NSCLC 中的JM 区的R988C突变可能是瘤的体细胞突变。在肺癌中 MET突变及其性质,目前的研究结果存在一定分歧。有人发现 MET突变率在小细胞肺癌细胞系中为 25%,而在小细胞肺癌临床标本中仅为 6.5%,提示肺癌细胞系中的 MET 基因突变率可能与人肺癌组织中的突变率有较大差异。也有学者认为,肺癌中的 MET突变均为种系突变,并且存在种族差异性。因此,有关 MET突变的研究有待进一步深入。
肿瘤细胞分子亚型研究显示,MET蛋白的配体HGF介导了MET信号通路。当HGF与MET蛋白结合后,后者发生二聚化和自身磷酸化,通过非EGFR依赖通路激活下游信号转导分子。然而,抗HGF中和抗体阻断实验发现,在5种MET过表达的细胞株中加入抗HGF抗体后MET磷酰化的水平并未发生改变,提示 MET基因的激活可能为配体非依赖方式介导。进一步研究显示,细胞-基质粘附抑制剂2-甲基丙烯酰基胆碱可使肺癌细胞株MET 及MET磷酸化水平明显下降,MET表达下调。细胞-基质粘附由粘附分子如整合素介导,因此,整合素介导信号通路在肺腺癌细胞株中维持MET的高水平有着重要作用,干预整合素介导的信号通路为抑制MET激活提供了新思路。
总之,MET的激活机制主要包括:(1) MET基因扩增或过表达;(2) MET基因突变; (3)细胞-基质粘附调控。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|