|
常建华,主任医师,硕士研究生导师,博士后。复旦大学肿瘤 医院肿瘤内科副主任、肺癌防治中心副主任。从事肿瘤的临床医 疗、教学和科研工作20 多年,承担及参与多项863 项目、国家自 然科学基金及省级科研项目,在国外及国内核心期刊发表SCI 论 著及论文30 余篇,参编6 部肿瘤学专著及教材。曾获得中华医学 科技奖三等奖及省级科学进步二等奖各一次。作为主要研究者参 与完成近20 项国际国内多中心随机对照临床研究, 主持研究者 发起的临床研究8 项,研究重点主要是晚期肺癌、食管癌、纵隔肿 瘤的个体化治疗。现任中国抗癌协会肿瘤临床化疗专业委员会委 员;中国抗癌协会临床肿瘤学协作专业委员会(CSCO)小细胞肺 癌专业委员会;上海市抗癌协会胸部肿瘤专业委员会委员及化疗 专业委员会主任; 上海医学会肿瘤专科分会胸部肿瘤学组成员; 美国临床肿瘤学会(ASCO)及国际肺癌研究协会(IASLC)会员。 |
Lutterbach B, Zeng Q, Davis LJ, et al.Lung cancer cell lines harboring MET gene amplification are dependent on MET for growth and survival[J].Cancer Res, 2007,67(5):2081-2088.
5
•晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的标准治疗方案有姑息放疗和化疗,但生存获益有限且毒性显著,因此需要大量工作研究NSCLC发生发展过程中的异常分子生物学,以便发现新的靶向治疗药物。
•配体肝细胞生长因子(hepatocyte growth factor,HGF)/离散因子(scatter factor,SF)与MET结合激活多条信号通路包括PI3K/磷酸肌醇依赖蛋白激酶1/AKT,Ras-Rac/Rho, Ras-丝裂原-活化蛋白激酶和磷脂酶C-r 通路。
•体内外实验均表明异常MET信号通路涉及到肿瘤的生长、维持和发展。动物实验表明转基因鼠组织特异性的过表达MET或HGF,可以促进肝细胞、气道上皮细胞和乳腺上皮细胞发生恶性转化。在人类,遗传性乳头状肾癌的发生和MET功能获得的种系突变有关。5%~10%胃癌、4%食管癌和4%肺癌发生 MET基因扩增。体外研究显示 MET基因扩增的胃癌细胞系依赖扩增的MET生长。而且 MET扩增和/或HGF过表达与很多肿瘤临床预后差相关。
为了深入探讨NSCLC中MET的功能,评估一组肺癌细胞系中 MET基因扩增、MET表达、MET通路激活以及细胞系对介导 MET敲除的短发夹RNA (shRNA)的敏感性情况。
研究条件:细胞系A549、H226、H596、Calu-1、SW900、SK-MES-1、H1048、H1993从美国标准培养收集所购买,EBC-1来自日本健康科学研究资源库,GTL-16由意大利托里诺医科大学 Giordano 和Comoglio 教授赠送。
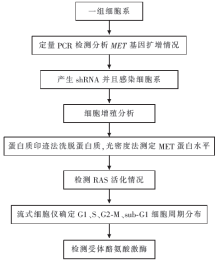
研究方法:体外细胞实验,流程见 图1。
检测NSCLC细胞系中MET的蛋白表达水平和活化状态,其中H1993和EBC-1细胞系表达高水平的MET,并且基线活化环酪氨酸(Y1234/1235)和酪氨酸停泊位点(Y1349) 高水平磷酸化。EBC-1和H1993中 MET基因扩增,而剩下的细胞系中未发现扩增。
EBC-1和H1993细胞系有活化的信号通路,在某些情况下,在质量和数量上与HGF刺激的活化通路不同。
为了确定NSCLC细胞系是否依赖MET生长。使用lentiviral vectors运输MET shRNA 进入EBC-1和 H1993 细胞系,并且感染后72小时发现高效的MET蛋白表达降低。MET shRNA治疗导致EBC-1和 H1993细胞系生长抑制,和蛋白敲除的量相应。尽管有效敲除 MET, A549和剩下细胞系的增殖不被MET shRNA抑制。除了影响细胞生长, MET shRNA导致H1993 和EBC-1细胞系显著的形态变化。去掉病毒后12小时,大部分细胞从圆形变扁平、粘附力增强。而在未治疗或对照中没有观察到这些形态变化。
使用流式细胞仪检测接受MET shRNA 治疗的EBC-1 和H1993的细胞周期。去掉病毒24小时内,EBC-1 和H1993 细胞系持续3~4倍的S期细胞减少, S期细胞百分比从19%(EBC-1)和17% (H1993)降到 5%。S期细胞的下降持续整个过程,表明细胞周期被阻断在G1-S。 EBC-1细胞系显著增加的 sub-G1数目表明这些细胞凋亡增加。
为了确定MET shRNA治疗后关键信号通路是否被抑制,实验发现 MET敲除后活化的ras完全丢失,H1993和 EBC-1细胞系产生显著的生长和形态改变,认为EBC-1和H1993细胞系依赖MET 生长。
实验结果强烈提示 MET扩增的NSCLC,可能对靶向MET治疗敏感。
近年来,分子靶向治疗在NSCLC中开创了新的治疗方式,尤其是EGFR-TKI及ALK抑制剂在晚期NSCLC患者中显示出明显的生存获益,诸如HGF/MET信号传导通路的研究显示可能为NSCLC提供新的治疗靶点。
MET基因位于人类7号染色体长臂(7q31),大小约110 kb,包括21个外显子。MET受体的配体是HGF也称SF。由于MET在不同细胞、不同分化阶段作用的底物不同,使其在特定的条件下表现出多种功能:(1)促进肝细胞、内皮细胞和黑色素细胞的分裂;(2)引起上皮细胞的分散,在胚胎发育过程中控制细胞的移动; (3)诱导细胞形态变化。在肿瘤细胞中有许多分子机制可以激活MET,最常见的方式是通过HGF和MET结合发挥作用。HGF和MET结合导致受体自身磷酸化,增强了MET酪氨酸激酶的活性,导致多种底物蛋白的酪氨酸磷酸化。在肿瘤组织同时高表达HGF和MET,形成正反馈,导致肿瘤的无限生长和侵袭行为。这种正反馈已经在神经胶质瘤、骨肉瘤、乳腺癌等恶性肿瘤中得到证实。
为了分析MET在NSCLC中所起的作用,该文评估了一组肺癌细胞株中 MET基因的扩增、表达,其信号传导通路的激活以及用shRNA介导下调MET之后细胞的变化。
首先明确MET在9个NSCLC细胞株中蛋白表达水平及激活状态:在高表达MET的H1993及EBL-1这两个细胞株中,活化的激酶环及激酶结合点均检测到高水平的磷酸化,并导致 MET的扩增,但这种活化并不是因HGF引起。相反,在低表达MET 的其余7个细胞株中磷酸化水平很低,且仅靠HGF 激活,同样也检测不出 MET扩增。
其次,明确信号传导通路的激活在有 MET扩增的细胞与无 MET扩增的细胞被HGF激活之间是否一致?与上述研究一致,结果显示仅在有 MET扩增的H1993及EBL-1这两个细胞株的β-catenin及δ-catenin中发现了明显上调的酪氨酸磷酸化,无 MET扩增的细胞株中则没有类似表现。
第三,确定 MET扩增对NSCLC细胞的生长是否重要。研究者通过慢病毒载体将MET shRNA转入EBC-1及H1993细胞中,发现能显著降低MET 蛋白的表达,并抑制细胞生长,使其数量在48~72小时内减少50%,且细胞形态也从圆形变扁、粘附能力增强。这些现象在其他细胞株均没有发生。流式细胞检测显示受抑细胞被停滞在G1-S期,从而导致细胞凋亡。而MET的受抑,同时还伴有AKT、ERK、catenin激酶磷酸化及活化ras的丧失,说明MET单个激酶的丢失,引起了多条信号通路的停止,继而导致细胞生长受抑,形态发生改变。通过受体酪氨酸激酶分析,发现在EBC-1及H1993细胞中EGFR1 及MET是主要的激活受体,随着MET的下调,EGFR激活位点的磷酸化水平也降低。结果提示EGFR是扩增的MET激酶下游信号传导路径的组成部分。以上这些实验结果强烈提示 MET扩增是NSCLC的一种亚型并可能对针对MET的靶向治疗有效。
近来,已证实EGFR靶向治疗期间 MET扩增的出现与另一种新的耐药机制有关,这减弱了TKI的疗效。文献报道,对吉非替尼耐药的NSCLC细胞株HCC827GR及细胞株NCI-H820的研究发现HCC827对吉非替尼获得性耐药是由 MET信号扩增所介导。HCC827GR对PHA-665752(一种针对MET的酪氨酸激酶抑制剂)或吉非替尼均耐药,但药物联用可明显抑制细胞生长;H820细胞对厄洛替尼及不可逆的EGFR抑制剂 CL-387785均不敏感;在两种细胞株中均发现只有阻断MET才能抑制ErbB3的活化。通过高通量基因组扫描在20.9%(9/43)的耐药患者中检测到 MET基因高扩增,高于未接受TKI治疗的NSCLC患者中的3.2%( 2=62, P=0.007)。来自9名患者的10份标本中有4份同时检测到 MET基因高扩增及 T790M突变。结论是 MET基因扩增激活ErbB3-PI3K信号途径导致NSCLC对吉非替尼产生耐药。 MET基因扩增的发生与EGFR T790M的存在无关。RNA干扰技术进一步验证了 MET信号扩增导致PI3K/Akt信号持续激活并维持ErbB3的磷酸化,这提示未来临床设计的EGFR-TKI获得性耐药的抑制剂不能仅阻断 EGFR T790M突变通路,对于存在 MET扩增的获得性TKI耐药可能还需要开发阻断MET/ErbB3/PI3K信号轴的拮抗剂。
目前,一些针对MET的靶向药物如单克隆抗体及小分子抑制剂等都已进入临床研究。 今年ASCO大会有三个大型临床研究报道了有关MET抑制剂治疗MET阳性NSCLC患者的结果:第一,Tivantinib+厄洛替尼治疗EGFR-TKI治疗失败的 EGFR突变阳性NSCLC患者的Ⅱ期研究,Tivantinib是非ATP竞争的高选择性MET小分子抑制剂,研究结果显示在有MET高表达及无 T790M突变的患者中,Tivantinib+厄洛替尼组总有效率更高,中位无进展生存期更长。第二,INC280联合吉非替尼治疗 EGFR突变、MET阳性NSCLC患者的疗效和安全性的Ⅰb/Ⅱ期单臂研究。INC280是一种口服的高选择性的MET抑制剂,在一组 EGFR突变阳性的NSCLC患者口服吉非替尼耐药后,检测发现有 MET扩增(拷贝数大于5个)或高表达(IHC++/+++)者,在吉非替尼基础上联合INC280,有效率为6/41 (15%)。更大规模的Ⅱ、Ⅲ期临床研究将进一步验证该药的疗效。第三,克唑替尼治疗 MET扩增晚期NSCLC的疗效和安全性研究。克唑替尼是 ALK融合基因的小分子抑制剂,对MET及ROS1阳性的细胞也有活性。研究结果显示克唑替尼治疗 MET中/高扩增NSCLC有临床获益 ,有效率分别为17%及67%(完全缓解率17%),疾病控制率均为84%。这些研究使我们看到一些很有希望的结果,期待后续研究进一步验证这些结论。
转化性研究的成果层出不穷,越来越多的生物靶点将被发现,相关的靶向药物也会日益增加,肿瘤的精准靶向治疗时代已经拉开了大幕,将展现给我们一个新的世界。