作者简介:黄雨晴(1987-),男,南昌人,硕士研究生,研究方向为高血压及相关疾病的临床研究。
2013年我国心血管疾病报告显示, 我国15岁以上人群高血压患病率约24%, 且年增长率约3%[1], 估计我国现有高血压患者大约2.7亿, 即每5个成年人中至少有1个高血压患者[2], 而且我国高血压呈现“ 四低” 特点[3], 即知晓率、治疗率、控制率和治疗依从率较低, 分别约为48%、40%、10%和30%, 未控制的高血压可促进动脉粥样硬化的进展, 导致靶器官损害, 甚至严重的并发症, 如:脑卒中、心脏病、肾脏病、外周血管疾病和眼底疾病等, 高血压并发症有“ 四高” 特点[3], 即发病率高、病死率高、致残率高和治疗负担高, 严重影响患者的生活质量和寿命, 同时也给患者及患者家庭带来严重的经济负担。难治性高血压患者比非难治性高血压患者心血管事件发生率高50%[4]。然而, 影响血压未达标的因素较多, 也给难治性高血压的诊断和治疗带来困难, 目前有效的诊断和治疗方法也在积极探索和开展, 在难治性高血压领域也取得了一定的成就, 近年来交感神经射频消融术治疗难治性高血压技术为治疗高血压作出了一定的贡献, 其它方法也在如火如荼地进行着。本文旨在归纳总结难治性高血压的临床特点、诊断方法和治疗方式, 以帮助临床医生更好地了解、发现和治疗难治性高血压。
在改善生活方式的基础上, 应用了合理的、足量的、联合的、最佳的和可耐受剂量的≥ 3种降压药物(包括利尿剂)后, 在一定时间内 (至少> 1个月) 药物调整、规律服药、按时监测的基础上血压仍在目标水平之上, 或服用≥ 4种降压药物血压才能有效控制, 称为难治性高血压[5]。
目前难治性高血压的患病率和流行特点并不十分清楚, 我国尚无准确的流行病学数据, 中国高血压最佳治疗试验(Hypertension Optimal Treatment Study in China, HOT-China)分析在大陆148个城市中招募54 590名成年高血压患者的结果发现, 中国难治性高血压与超重/肥胖和代谢综合征相关, 发生率仅为1.9%[6]; Persell等[7]分析2003-2008年全国健康和营养检查调查的数据, 发现美国8.9%的成人高血压患者符合难治性高血压标准; 西班牙的一项研究报道[8], 14.8%的高血压患者为难治性高血压; Hanselin等[9]进行的一项回顾性研究按至少同时使用4种抗高血压药物为标准分析了一个大型美国人群样本, 结果发现2.6%的患者为难治性高血压; 另一项回顾性队列研究从两个综合健康计划招募了205 750名偶发性高血压患者, 结果发现从初始治疗开始一年半后(中位时间)有1.9%的患者发展为难治性高血压[10]; 据美国心脏协会2008年关于难治性高血压的诊断、评估和治疗的科学声明中所述:小样本研究显示难治性高血压的患病率在普通门诊中约为< 5%, 参考近几年的临床试验结果、经常就诊的高血压患者的数据以及高血压研究中心的现有数据, 随着人口老龄化的发展及肥胖人口的增多, 难治性高血压的发生率也随之增加, 推算难治性高血压的患病率为5%~30%[11]。
难治性高血压的病因及病理生理学机制复杂多样, 是在神经、体液和内分泌等多种因素单独或共同作用下产生的。高盐饮食、吸烟嗜酒、超重和肥胖、颈动脉压力反射功能减退和交感神经兴奋是高血压患者血压难以控制的基本和重要原因[12], 研究表明[13], 循环和组织中的肾素血管紧张素醛固酮系统(renin-angiolensin-aldosterone system, RAAS)的激活以及中枢或局部组织, 特别是肾脏交感神经活性的过度增高会启动氧化应激过程和炎症因子从而加速动脉硬化的发生和进展, 加重血管结构和功能的异常, 进而使增高的血压难以获得控制, 研究也显示[14], 交感神经以及RAAS活性增强及持续存在是其另一发病机制, 多重因素共同影响交感神经及RAAS激活, 如胰岛素抵抗、脂肪细胞因子、内皮细胞功能障碍、间歇性低氧血症、体内容量负荷过高、醛固酮等作用于中枢神经系统以及动脉化学感受器和压力感受器的功能失调等。此外, 我国学者领导的高血压病研究小组通过研究发现, 难治性高血压除上述因素外, 抗AT1受体自身抗体的存在是导致难治性高血压的重要因素, 因为抗AT1受体自身抗体可模拟血管紧张素而激动血管紧张素受体, 引起血压升高; 同时, 由于常规的降压药物不能阻断这种抗体的作用, 而影响了高血压的治疗, 曾临床试用近40例, 均获得满意的效果, 从而证实了抗AT1受体自身抗体是导致高血压发生发展的新病因[15, 16]。肾脏在难治性高血压的发病过程中也具有重要作用, 其中, 肾脏局部交感神经过度激活是其发病基础以及重要的病理生理学机制之一[17]。
肾交感神经分为传入神经和传出神经, 其中传出神经的激活产生和分泌去甲肾上腺素。去甲肾上腺素水平升高是肾交感神经活性增高的标志, 使水钠重吸收增加、肾血管收缩从而使肾血流量减少, 同时它还激活醛固酮系统增加肾素分泌而升高血压, 而传入神经的过度兴奋可激活中枢神经系统, 从而分泌加压素而升高血压[18]。交感神经切除或交感神经阻滞剂作用于肾缺血/再灌注后的动物模型可使其去甲肾上腺素分泌量明显下降, 进而有效地控制血压, 反之, 血压难以控制。
在治疗的基础上, 血压的测量是诊断的基本也是最重要的方法, 而在合理的治疗后正确地测量评估血压又是发现和诊断的前提。
要求受试者坐位安静休息5分钟后, 30分钟内禁止吸烟、饮咖啡和茶并排空膀胱后测量, 测量前选择定期校准的水银柱血压计, 或者经过验证的电子血压计, 大多数的成年人使用气囊长22~26 cm、宽12 cm的标准规格袖带, 测量坐位时的上臂血压, 上臂应置于心脏水平, 以柯氏音第Ⅰ 音和第Ⅴ 音(消失音)确定收缩压和舒张压水平。连续测量2次, 每次至少间隔1~2分钟, 若2次测量结果差别比较大(5 mmHg以上), 应再次测量, 首诊时要测量双上臂血压, 以后通常测量较高读数一侧的上臂血压, 对疑似有体位性低血压者, 应测量直立位血压, 在测量血压的同时, 应测定脉率。使用水银柱血压计测压读取血压数值时, 末位数值只能为0、2、4、6、8, 不能出现1、3、5、7、9, 并应注意避免末位数偏好。
建议新诊断的高血压患者采用上臂式肱动脉全自动血压表或台式水银血压计连续测量2周, 血压波动明显的患者连续3~7天, 早晚各1次, 同时注意早上晨起服药前测量, 晚上在晨起服药后至少12小时或睡前测量, 每次测量3遍, 计算平均值。家庭自测血压≥ 135/85 mmHg者可诊断为高血压。
目的是了解全天血压的波动以及增高的程度, 排除假性高血压。此方法诊断高血压的标准:全天(24小时)> 130/80 mmHg, 白昼> 135/85 mmHg, 夜间> 120/87 mmHg, 且要全天24小时监测有效次数达到85%以上为有效检测。但对于精神失常, 上肢肢体残疾, 肥胖者臂围> 40 cm, 严重失眠和长期熬夜或夜班者不宜使用。
在诊室血压测量的基础上建议进行连续家庭自测血压和24小时动态血压监测以便排除白大衣高血压、同时可以了解血压的特殊形态等, 如杓型、非杓型、超杓型、晨峰现象和清晨高血压, 以便有针对性地选取合适的治疗药物, 争取血压达标。
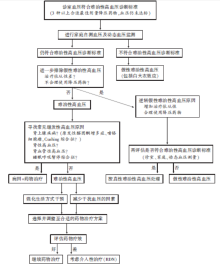
影响难治性高血压的因素较多[12, 13, 14]:(1)血压测量不准确而产生假性高血压; (2)治疗依从性差, 不按时规律服药治疗; (3)生活方式不健康:高盐摄入, 过度焦虑, 大量吸烟, 过度饮酒, 重度肥胖, 长期慢性疼痛等; (4)服用影响血压的药物:如天然甘草, 非甾体类抗炎药物等非麻醉类镇痛药, 口服避孕药物, 类固醇药物, 环孢素, 促红素, 麻黄素, 兴奋剂和过量酒精等; (5)高血压药物治疗不充分:如药物用量不足或未使用利尿剂或联合方案不正确; (6)病史和体检内容是否齐全, 病史内容包括病程、严重程度、治疗依从性、以往用药反应、白天睡眠情况、打鼾情况、有无外周动脉或冠状动脉疾病等, 体检内容应包括眼底镜检查, 查看视网膜病变的程度, 还要注意到颈动脉、股动脉和腹主动脉的杂音情况, 判断是否存在继发性高血压; (7)继发性高血压:常见的如睡眠呼吸暂停综合征, 原发性醛固酮增多症, 肾实质性高血压, 肾血管性高血压, 嗜铬细胞瘤, 并应警惕精神心理因素所导致的难以控制的高血压, 对疑似继发性高血压的患者, 建议到有条件检查的医院进行诊断和鉴别诊断。考虑以上继发性高血压时要针对性地做相关检查, 生化指标的测定包括:常规的代谢谱检查(钠、钾、氯、糖、肌酐等); 动态对比早上血浆醛固酮、血浆肾素或者肾素活性, 以发现原发性醛固酮增多症; 留取24小时尿, 评估患者的钠、钾摄入量并计算肌酐清除率; 测定24小时尿和血浆的肾上腺素, 用以筛查嗜铬细胞瘤; 嗜睡打鼾者可行睡眠呼吸监测筛查睡眠呼吸暂停综合征。无创性影像学检查用来筛查肾动脉狭窄和嗜铬细胞瘤, 推荐应用CT或MRI。专科检查方法的选择应基于高血压患者特殊的临床表现和相应的实验室检查提供的基本线索, 围绕着疑似病因进行相应的专科检查, 避免盲目地进行继发性高血压的病因筛查, 病因的诊断对于继发性高血压患者治疗策略的选择和预后的判断具有十分重要的意义。难治性高血压的具体诊断流程详见图1。
由于难治性高血压也是一种“ 心血管综合征” , 难治性高血压患者也多伴有如超重或肥胖、吸烟、睡眠呼吸暂停综合征、糖尿病及慢性肾脏疾病等其他心血管疾病危险因素, 因此其心血管疾病风险也显著增加, 需根据患者心血管总危险度, 关注多种危险因素的综合干预, 治疗方式也多样, 根据患者具体情况制定个体化治疗措施。
矫治不良生活方式包括减轻体重, 低盐低脂饮食, 限酒, 增加体力活动, 同时注意心理调节, 减轻精神压力等[12]。具体措施为:(1)食物多样化, 粗细搭配, 营养平衡; (2)总摄入量要与身体运动相平衡, 每天中等强度活动30分钟左右, 保持每周活动5~7天或150分钟以上, 保持健康体重, 使体质量指数维持在18.5~24 kg/m2之间, 腰围男性< 90 cm, 女性< 85 cm; (3)低盐低脂低胆固醇饮食, 每日脂肪总量不能超过总能量的30%, 每日烹调油用量控制在20~30 g, 摄入充足的多不饱和脂肪酸和适量的单不饱脂肪酸, 膳食中胆固醇摄入量不超过300 mg/d; (4)限盐补钾, 每日摄入食盐不超过6 g, 摄入钾70~80 mmol/L; (5)戒烟限酒, 严格限烟并避免被动吸烟, 不饮酒或适量饮酒, 建议男性每天饮酒量(酒精)不超过25 g, 相当于50度白酒50 mL, 或38度白酒75 mL, 或葡萄酒250 mL, 或啤酒750 mL, 女性减半; (6)陶冶情操, 调整心态, 作息合理, 精神放松, 保持良好的心理素质, 有精神问题要及时看心理医生。
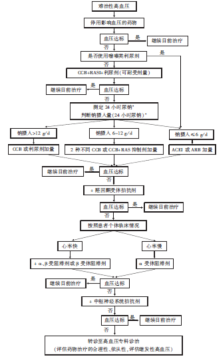
降压药物的选用原则包括:停用干扰血压的药物, 正确使用利尿剂, 合理联合用药, 尽量使用长效制剂, 个体化用药[12]。多数难治性高血压患者需3种以上的降压药物, 应尽量选择长效或固定复方制剂以减少给药次数和片数, 尽量安排为全天用药一次或分成早、晚服用, 以控制全天血压, 避免使用影响降压效果的药物或减至最低剂量。美国高血压学会发布的联合应用降压药物意见书建议的优先选择的方案是血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitors, ACEI)或血管紧张素受体拮抗剂(angiotensin receptor blocker, ARB)联合钙离子拮抗剂(calcium
channel blockers, CCB)及利尿剂, 血压仍不能达标者考虑加用螺内酯或联合β -受体阻滞剂、α -β 受体阻滞剂或α 受体阻滞剂。若仍不能达标, 则中枢神经抑制药物可作为联合方案的第五种降压药物的选择。具体用药选择流程详见图2。
由于难治性高血压患者心血管风险明显增加, 控制血压、延缓靶器官损害和减少并发症的发生是治疗的重要环节和目标, 但是在进行规范合理的强化治疗干预后仍有部分患者的血压控制不满意, 同时结合难治性高血压的发病机制, 近年来以肾动脉交感神经射频消融术(renal denervation, RDN)[13, 14]、颈动脉窦刺激器[21]和深部脑刺激治疗[22]为代表的有创性治疗逐渐引起人们的关注, 有望成为药物治疗控制不良患者的一种新的治疗方法。
6.3.1 肾动脉交感神经射频消融术治疗难治性高血压
人体研究和动物实验均表明交感神经的过度激活与高血压的发生发展有着密切关系[23], 肾脏是血压调节的重要器官, 肾自主传入传出神经纤维几乎均与交感神经活动有关, 所以肾去交感化是降压治疗的“ 理想靶点” 。其中第10胸椎至第1腰椎的肾交感神经随肾动脉进入肾脏, 对调节机体的血压起到决定性作用。肾交感神经通过两种途径影响血压[14]:(1)刺激传出神经通过肾上腺导致水钠潴留、肾素释放、肾动脉收缩, 进而导致持续性血压升高; (2)经肾传入神经发送信号到中枢神经系统, 同时传输到对侧肾脏, 这些信号使交感神经活性增强, 通过传出神经从下丘脑发送信号到肾脏及全身其他器官, 发挥血管紧张性调节作用, 同时改善外周胰岛素抵抗、左心室肥厚、心脏舒张功能不全以及睡眠呼吸暂停综合征。总体上, 交感神经系统在肾脏调节全身血压中有明显作用, 反之, 肾脏也是全身交感神经活性中的重要调节器官。基于上述机制, 阻断肾动脉交感神经的射频消融术的Symplicity HTN系列研究应运而生。
6.3.1.1 Symplicity HTN-1研究
前期动物实验研究为人体内进行RDN安全性及有效性的研究做了充足准备。Symplicity HTN-1随之诞生[24], 该研究由澳大利亚的Krum医生组织, 是一项非随机多中心研究, 用以评价RDN的有效性及安全性, 2007-2008年澳大利亚及欧洲5个中心共纳入50例患者, 其中5人因肾动脉解剖结构不适合而被排除, 其余45人接受RDN, 术后随访1年。纳入标准是经≥ 3种降压药物(包括利尿剂)治疗后收缩压仍≥ 160 mmHg, 主要终点指标是术后1个月、3个月、6个月、9个月及12个月的血压下降幅度及安全性, 次要终点指标是术后的肾脏功能(肾小球滤过率)和去甲肾上腺素的分泌。术后第1个月时收缩压及舒张压明显下降, 分别为14 mmHg和10 mmHg, 术后第12个月分别下降27 mmHg和17 mmHg。试验组样本已扩大至153例, 随访2年后收缩压(systolic blood pressure, SBP)及舒张压(diastolic blood pressure, DBP)分别下降32 mmHg和14 mmHg, 36个月时为39 mmHg和19 mmHg, 这一惊人结果证实了此方法可长期获益。此外, 在手术后, 交感神经活性降低, 肾脏分泌的去甲肾上腺素明显下降者达到47%, 术后肾功能无明显改变; 在并发症方面, 45例患者中有4例存在手术并发症(3例股动脉假性动脉瘤及1例患者术后出现迟发性的肾动脉夹层)与消融治疗无关, 无需特殊处理。2009年, 澳大利亚施莱克(Schlaich)公布了其3年随访结果。研究显示, 在34例完成3年临床随访的难治性高血压患者中, 诊室测量的平均收缩压较术前降低31 mmHg, 舒张压降低16 mmHg, 并且与术后不同时间点(1个月、6个月、24个月)相比, 患者血压均有显著持续性下降, 亚组分析显示, 对老年、糖尿病、肾功能不全患者, RDN均能长期有效降压, 同时, 在3年临床随访中, 患者未出现新发血管并发症。
6.3.1.2 Symplicity HTN-2研究
该研究是一个多中心的前瞻性随机研究[25], 共纳入106例患者, 纳入标准是经≥ 3种降压药物治疗后患者SBP≥ 160 mmHg或合并2型糖尿病患者血压≥ 150 mmHg, 所有患者被按照1∶ 1比例随机分入RDN手术组(前期的药物治疗未中断)和药物治疗对照组(维持前期的药物治疗)。主要终点指标是6个月后诊室血压的变化, 次要终点指标是手术的短期及长期安全性, 不良事件的定义是6个月后肾小球滤过率下降> 25%或肾动脉造影显示新发的肾动脉狭窄> 60%。次要终点指标包括心血管不良事件(心肌梗死、猝死、心力衰竭、脑缺血、外周血管血运重建等)、24小时动态血压的变化、血压下降> 10 mmHg的发生率等。106例初始入选的患者中有100例进行了最终的评价, 另外6例患者因失访而排除。基线平均诊室血压为178/96 mmHg, RDN组平均血压下降32/12 mmHg(P< 0.000 1), 相反, 对照组平均血压下降1/0 mmHg(SBP, P=0.77; DBP, P=0.83)。两组24小时血压波动趋势相似, 仅手术组血压绝对值降低。手术组SBP下降> 10 mmHg的发生率为41.8%, 对照组为18.3%。手术组19.4%的患者达到了SBP≤ 140 mmHg的降压要求, 而对照组仅3.6%的患者达到要求。研究中没有发生任何严重的导管相关并发症, 仅有一些轻微并发症出现, 包括1例股动脉穿刺部位假性动脉瘤、1例术后血压显著下降、1例泌尿系感染、1例感觉异常及后背疼痛, 经治疗后均好转并且未再引起严重并发症。两组患者肾功能均无明显改变。1例手术组患者术后6个月肾动脉狭窄加重, 但是不需要介入治疗, 狭窄处并未行射频消融治疗, 心血管不良事件两组无差异。
6.3.1.3 Symplicity HTN-3研究
该研究由Bhatt博士(布莱根妇女医院)和Bakris博士(芝加哥大学)主持[26], 是一项随机、假手术对照、盲法试验, 共纳入535例严重的难治性高血压患者。研究者对535例患者24小时动态血压数据进行了分析, 其中364例患者随机分配到去肾交感神经术治疗组, 171例为对照组。两组基线时血压水平无明显差异。治疗组基线时24小时动态血压均值日间和夜间分别为159.1/88.0 mmHg和152.5/82.5 mmHg。6个月后, RDN组平均收缩压降低14.13 mmHg, 假手术组降低11.74 mmHg, 这-2.39 mmHg的差异无统计学意义。考虑了24小时收缩压变化因素, 6个月时RDN组收缩压降低6.75 mm Hg, 对照组降低4.79 mm Hg, 1.96 mm Hg的差异仍无统计学意义。研究人员得出结论, 去肾交感神经术与假手术相比并未降低难治性高血压患者的6个月时收缩压水平。6个月时, Bakris等[27]报道的随访结果表明治疗组24小时动态收缩压降低6.8 mmHg, 对照组降低4.8 mmHg, 两组无显著差异。两组日间收缩压降低水平无显著差异, 夜间收缩压治疗组较对照组低3.3 mmHg, 但差异亦无统计学意义(P=0.06)。虽然Symplicity HTN-3试验未能证实RDN有助于降低难治性高血压患者的血压水平, 但却证明了该技术的安全性。因此, 目前不应放弃对此技术的探索, 应鼓励少数技术设备完备的大型中心性医院继续进行更为深入的研究。
6.3.1.4 全球Symplicity注册研究
在2014年美国心脏病学会大会上, 公布了全球Symplicity注册研究1 000例数据分析结果。研究显示, 与基线相比去肾交感神经术显著降低患者的诊室血压和动态血压。这与前一天公布的Symplicity HTN-3试验结果恰恰相反。全球Symplicity注册研究[28]由Michael Bö hm博士(德国Saarland大学医院)主持, 是一项前瞻性、开放标签的(非盲法)的多中心注册研究, 预计纳入5 000例与交感神经系统激活相关的难治性高血压患者。在本研究中, 患者平均服用4.5种降压药物, 其中79%服用β 受体阻滞剂, 67%服用ARB类, 76%服用CCB类, 78%服用利尿剂, 约15%服用直接血管扩张剂。6个月时, 随访的751例患者诊室收缩压平均下降值为11.9 mmHg; 基线收缩压≥ 160 mmHg的患者, 平均下降值为21.4 mmHg。6个月时, 进行动态血压监测的404例患者动态血压平均下降值为7.9 mmHg。Symplicity HTN-3试验中, 动态血压平均下降值为6.8 mmHg。而在Symplicity HTN-3试验中, 诊室收缩压平均下降值为14.1 mmHg和11.7 mmHg(治疗组vs.对照组)[29]。
Bö hm指出, 总体来说这一全球最大的真实世界RDN研究结果相当可观, 血压下降值远远大于Symplicity HTN-3试验。但是, 上述差异可能是因为两个研究的降压治疗剂量和纳入人群不同所致, 注册研究没有纳入非裔美国人, 更重要的是, 注册研究没有假手术对照组, 无法对可能的安慰剂效应做出评估。
参与注册研究的医生至少已经进行了30例RDN手术, 大多数参加了Symplicity HTN-1和HTN-2研究, RDN操作经验也可能部分解释注册研究的阳性结果。
6.3.2 颈动脉窦刺激器治疗难治性高血压
生理状态下, 血压上升时, 延髓背侧孤束核的传入神经冲动增加; 随着血压的增高通过舌咽神经和迷走神经上传, 然后大脑将血压增高的信号内容转换为血压升高, 试图将信号传入到各终末效应器官而使血压下降。来自延髓腹外侧区的喙段和疑核是反射弧的效应器, 通过增加副交感活性和减少交感输出, 使血管舒张、心率减慢、排钠增多, 最终产生降压效应[30]。目前, 经FDA批准, 在美国和欧洲的50家临床研究中心进行了随机、双盲、平行设计的Rheos Pivotal试验, 用以验证这种方法的安全性和有效性。对符合纳入标准的265例患者植入治疗装置, 以随机方式(2∶ 1)将患者分为A组和B组, A组装置在术后立即工作, B组装置处于电源关闭状态(术后6个月打开)。在2011年8月美国心脏病学会杂志上公布了后续研究结果, 对受试者进行为期(21± 8)个月的随访, 三个主要终点指标: 降压的长期有效性(12个月)、器械的长期安全性和短期(6个月)安全性达到试验设计目标, 而降压的短期有效性(6个月)和器械植入30天的安全性未达到试验目标, 短期有效性因为“ 安慰剂效应太好” 使治疗组和对照组达成血压控制目标的差值不够, 30天无事件生存比例为75%, 副作用主要是颈动脉窦电极放置引起的永久性神经损伤(麻痹、吞咽困难、发音障碍等4.8%)、外科并发症(4.4%)、暂时性神经损伤(4.4%)和呼吸系统问题(2.6%)等, 目前此研究仍在继续观察, 研究者也在探讨进一步降低治疗相关副作用的措施[31]。
此外颈动脉窦刺激器系统对心脏结构和功能的作用研究也在进行, 研究者对8个中心的34名受试者进行了超声心动图的随访, 其中21名患者有完整的12个月随访资料, 结果显示:12个月时, 除心率和血压下降, 左心室壁厚度、左心房直径、左心室质量和指数以及每搏功也都有减少, 而左心室舒张功能无影响, 因而研究人员认为颈动脉窦刺激可以改善难治性高血压患者的左心房和左心室的结构和功能, 此系统对心脏的保护效应将继续在随机临床试验中进行观察, 有待期望得到我们理想的结果[32]。
6.3.3 深部脑刺激治疗难治性高血压
生理学研究表明, 在背侧部中脑水管的断面周围, 中脑横切面上, 有一厚层灰质, 称为导水管周围灰质区(periaqueductal gray, PAG), 是边缘中脑区之一, 动物实验证实其呈圆柱形, 不仅与传入神经纤维联系广泛, 且和许多脑区存在双向联系, 是呕吐、发音、防卫和排尿等行为的最后整合器, 参与呼吸中枢调节、心血管活动以及整合疼痛的情绪反应。PAG的降压区(腹外侧区)可通过MRI立体定位引导, 在PAG植入电极深部脑刺激治疗慢性顽固性神经性疼痛已有30年历史, 其间发现还具备降压效应[33]。
Green等[34]第一个报道了通过刺激PAG治疗高血压的病例, 在对1名61岁患者深部脑刺激治疗慢性疼痛的过程中发现, 将电极置于大脑不同部位可引起血压波动, 当以振幅2 v、频率30 Hz刺激PAG, 血压明显降低(由157.4/87.6 mmHg降至132.4/79.2 mmHg), 刺激与降压效应出现的潜伏期不足5 s, 稳定约需30 s; 撤除刺激后, 血压迅速回升, 20 s达到始值, 将电极部位提高3 mm, 应用相同参数又可致血压上升; 2011年, Patel等再次报道PAG深部脑刺激治疗难治性高血压, 对患者实施PAG深部脑刺激的四极电极植入, 放置部位和刺激参数选择能符合疼痛治疗, 仪器开启能显著降低诊室和动态血压, 呈明确“ 开关效应” [35]。
但由于该研究只是该技术应用于小规模单中心小样本病例, 尚需大规模的动物和人体实验来证明其降压的确切效果, 而因为其卒中风险和高昂的费用也限制其在临床上的大规模开展, 但该技术同样说明了自主神经系统异常在原发性高血压中的作用, 为我们将来的研究开辟了一条新思路。
6.3.4 其它方法 据2013年12月11日发表在《美国医学会杂志》上的一则研究披露, 在罹患阻塞性睡眠呼吸暂停及需要3种或更多药物控制高血压的患者中, 和没有接受持续气道正压通气(continuous positive airway pressure, CPAP)的患者相比, 接受持续CPAP治疗达12周可带来24小时平均血压和舒张压的下降以及夜间血压模式的改善。西班牙瓦伦西亚的Martinez-Garcia等[36]在194名罹患难治性高血压与阻塞性睡眠呼吸暂停症(obstructive sleep apnea, OSA)的患者中就CPAP治疗对血压水平及夜间血压模式的功效进行了评估。该试验是在西班牙的24个教学医院中开展的; 数据收集时间为2009年6月至2011年10月。患者在维持平时的血压控制药物的同时被随机指派接受CPAP(n=98)或不接受CPAP(对照n=96)。在研究过程当中, 血压的改变在研究组间通过意向治疗进行分析, CPAP组24小时平均血压下降超过3.1 mmHg, 24小时舒张压下降超过3.2 mmHg; 但与对照组相比, 其24小时收缩压的改变则没有统计学意义。此外, 在12周随访时所展现夜间血压杓型模式(即与平均日间血压相比, 平均夜间血压下降至少10%)的患者百分比在CPAP组要比在对照组更高(35.9% vs. 21.6%)。在CPAP应用的小时数与24小时平均血压降低之间存在着正相关性; 另外一个由Lloberes领导的随机对照研究CPAP对难治性高血压患者血浆醛固酮浓度的影响和阻塞性睡眠呼吸暂停试验表明, CPAP对OSA合并难治性高血压的患者不仅有很好的降压效果, 还可降低患者血浆醛固酮浓度[37]。此外, 对于肾功能衰竭的难治性高血压患者可以进行血液透析[38], 此方法对部分肾功能不全的高血压患者也有一定的疗效。
难治性高血压是心血管综合征中的一种, 其有更高的心血管疾病风险, 及时发现及时治疗, 延缓靶器官损害和减少并发症的发生刻不容缓, 但引起血压顽固难以控制的因素多样, 需要仔细甄别病因, 药物治疗剂量不足及不合理、用药时间不合适、生活方式不良、治疗依从性差等均是重要的原因, 继发性高血压也会导致血压难以控制, 非心血管专科医生对难治性高血压的治疗和对引起血压难控制缺乏认识也是一个重要的原因。尽管已经有多种不同机制的降压药物, 而合理、最佳、可耐受剂量的多种药物联合治疗(包括利尿剂)是控制血压的关键, 其中利尿剂、螺内酯、α -β 受体阻滞剂及中枢神经拮抗剂的应用也不容忽视, 但仍有较高比例的高血压患者未能得到较好控制。对于药物控制无效的真性难治性高血压患者来说, 有创性治疗技术可能是一种有效的治疗方法, 但是因其还处于研究阶段, 需严格掌握适应证和禁忌证, 按操作规程慎重、有序开展, 同时提倡有计划地开展前瞻性、多中心、随机对照研究, 此外, 对于高血压专科的建设、高血压专科医生的培养也是一个值得探索的方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|