作者简介:辛田(1988-),男,黑龙江大兴安岭人,硕士研究生,从事肺癌化疗及靶向治疗研究。
大部分进展期非小细胞肺癌患者为表皮生长因子受体野生型,在文献报道中,野生型患者普遍对表皮生长因子受体酪氨酸激酶抑制剂不敏感,但仍有临床研究发现,部分野生型患者可以从酪氨酸激酶抑制剂的治疗中获益。目前尚无预测因子能够预测表皮生长因子受体酪氨酸激酶抑制剂对野生型患者的疗效。
The major proportion of advanced non-small cell lung carcer does not contain activating mutations in the epidermal growth factor receptor (EGFR), which is called EGFR wild type (WT). Despite EGFR-WT patients who lack the sensitivity of EGFR tyrosine kinase inhibitors (TKI), there are some evidences demonstrating that some EGFR-WT patients can get benefit from EGFR-TKI. No prognostic biomarkers can predict outcomes of EGFR-WT treated by TKI so far.
自从2003年吉非替尼(易瑞沙)上市, 非小细胞肺癌(non-small cell lung cancer, NSCLC)的治疗进入了分子靶向治疗时代。早期的一些Ⅱ 期研究中, 吉非替尼(Gefitinib)/厄洛替尼(Erlotinib)在未经选择的患者中表现出了很好的疗效[1, 2, 3]。而随着研究的不断进展, 有研究者发现表皮生长因子受体(epidermal growth factor receptor, EGFR)基因突变与酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)的疗效有关, 这一发现随后在多项临床研究中得到证实[4]。EGFR野生型(wild type, WT)患者并非完全不能从EGFR-TKI的治疗中获益, 因此“ EGFR-WT患者是否应该使用EGFR-TKI” 成为临床工作者争论的焦点。本文综述了多项有关EGFR-WT患者治疗的临床研究, 探讨该亚组当前临床实践中TKI是否可以应用及可能的预测因子。
由于TKI应用于临床的初期尚不知晓其疗效与EGFR突变的关系, 早期的临床研究并没有EGFR突变的信息, 但随后一些大型研究复检了患者的EGFR状态, 并分析了EGFR-WT亚组的疗效。
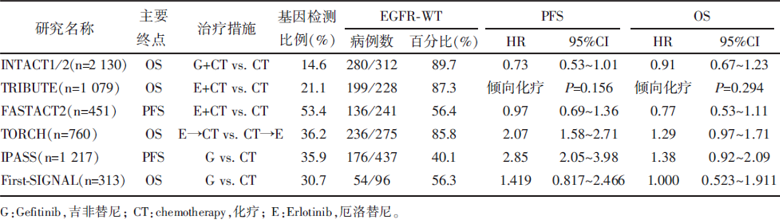
INTACT1、INTACT2是对比Gefitinib联合化疗与单纯化疗疗效的Ⅲ 期临床研究, 在其随后发布的数据分析中, EGFR-WT亚组患者组间总生存期(overall survival, OS)与无进展生存期(progression-free survival, PFS)均无显著差异[5, 6, 7]。这一结果与另外两项对比Erlotinib联合化疗与单纯化疗的Ⅲ 期研究(TRIBUTE, FASTACT2)一致[8, 9, 10]。
TORCH研究对比的是一线Erlotinib进展后使用化疗与一线化疗进展后使用Erlotinib的疗效, EGFR-WT的首次PFS 风险比(hazard ratio, HR)2.07[95%置信区间(confidence interval, CI), 1.58~2.71], 提示一线使用Erlotinib疾病会更早进展, OS与总PFS亦均倾向于使用传统化疗[11]。值得注意的是, 一线使用Erlotinib后出现进展的人群中有36%(121/333)的患者因疾病迅速进展而死亡, 没有进入后续治疗。
2009年发表的IPASS研究入组条件是腺癌、女性、不吸烟或轻度吸烟, 即优势人群, 对比Gefitinib与化疗的疗效[12]。研究采用精确度更高的扩增受阻突变系统(ARMS)检测EGFR突变状态, 更加准确地区分了EGFR突变型(mutant type, MT)和WT两组人群。在EGFR-WT亚组, PFS HR 2.85(95%CI 2.05~3.98, P< 0.001), 提示化疗疗效明显优于TKI, 但化疗的优势未能转化至OS, OS未得出显著差异。与之设计类似的韩国研究First-SIGNAL也得到了相近结果, 但由于样本量过少, PFS与OS均未得出显著差异[13], 详见表1。
| 表1 TKI在EGFR-WT晚期NSCLC一线治疗的临床应用情况 |
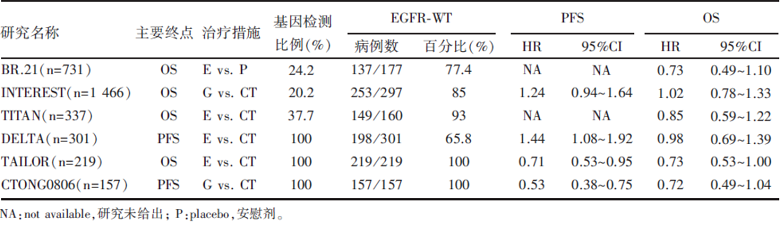
BR.21是一项对比Erlotinib与安慰剂的临床研究, 2005年发表的后续分析中, EGFR-WT亚组数据显示, TKI疗效不优于安慰剂, OS的HR为0.73(95%CI 0.49~1.10)[14, 15]。2013年Osarogiagbon等[16]对BR.21的部分标本再次做了分析, 在150例EGFR-WT患者中, Erlotinib延长了PFS, 而OS则没有显著性差异。
INTEREST和TITAN都是对比TKI与化疗的Ⅲ 期临床研究, 无论总人群还是EGFR-WT亚组均未得出统计学意义上的疗效差异[17, 18, 19]。INTEREST研究EGFR-WT亚组PFS的HR为1.24(95%CI 0.94~1.64), OS的HR为1.02(95%CI 0.78~1.33), 而TITAN的WT亚组OS的HR为0.85(95%CI 0.59~1.22)。日本一项类似的临床研究DELTA在EGFR-WT亚组得出了差异有统计学意义的结果, 其PFS的HR 1.44(95%CI1.08~1.92), 但与IPASS研究结果相同的是, 化疗组PFS的优势未能转化为OS的优势, HR 0.98(95%CI 0.69~1.39)[20]。
与一线不同的是, 二/多线治疗EGFR-WT对比TKI与化疗的研究中有前瞻性研究。2013年7月在线发表的TAILOR研究入组患者均为EGFR-WT的晚期NSCLC, 且经过一线含铂双药化疗后病情进展, 对比多西紫杉醇单药化疗与Erlotinib[21]。化疗组中位OS达到8.2个月, 而TKI组仅5.4个月, HR 0.73(95%CI 0.53~1.00); 化疗组中位PFS为2.9个月, TKI组为2.4个月, HR 0.71(95%CI 0.53~0.95)。随后在2013年世界肺癌大会上, CTONG0806研究公布最终数据, 培美曲塞化疗组中位PFS达5.6个月, Gefitinib组1.7个月, HR 0.53(95%CI 0.38~0.75); 中位OS化疗组12.4个月对Gefitinib组9.6个月, HR 0.72(95%CI 0.49~1.04); 两组疾病控制率分别为61.3%(化疗)和32.0%(TKI), P< 0.001[22, 23], 详见表2。
| 表2 TKI在EGFR-WT晚期NSCLC二线和多线治疗的临床应用情况 |
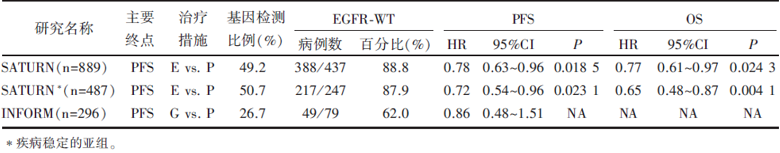
维持治疗是肿瘤内科治疗理念的一个飞跃, 关于TKI维持治疗的研究并不多, 2010年发布的SATURN研究探讨了一线含铂两药化疗后未进展患者使用Erlotinib维持治疗的有效性[24]。数据显示, Erlotinib相比安慰剂能显著延长EGFR-WT亚组的PFS及OS。2012年发表的后续数据分析中, 一线治疗后获得疾病稳定的亚组患者中的EGFR-WT人群仍然能够从Erlotinib治疗中获益[25]。另一项研究INFORM的数据并没有支持这一结果, 该研究发现EGFR-WT亚组PFS的HR为0.86(95%CI 0.48~1.51), 提示WT人群使用Gefitinib和安慰剂并没有差异[26]。详情见表3。
| 表3 TKI在EGFR-WT晚期NSCLC维持治疗的临床应用情况 |
虽然尚无前瞻性研究对比EGFR-WT患者一线使用TKI和化疗的疗效, 但既往研究WT亚组分析中, 化疗组的生存优势明显, TKI组近似安慰剂的总有效率亦说明该亚组对TKI不敏感。因此从伦理角度出发也不接受进行此种前瞻性研究。在对比TKI+化疗与单纯化疗的研究中, WT亚组的生存无明显差异, 反而副反应增加, 说明在化疗基础上添加TKI并不是一个合适的选择。无论单独使用还是联合化疗, TKI在EGFR-WT患者一线治疗中都无法提高疗效。
晚期NSCLC二线以后的化疗有效率普遍较低, 而化疗相关的副反应并没有减少, 累计毒性亦明显。TKI与化疗药物不同的毒性作用点使其在二线之后的治疗有了应用的可能。虽然早期的一些临床研究的结果提示WT患者二线使用TKI疗效并不劣于化疗, 但其结果仅仅是亚组分析, 存在偏倚, 而2013年发表的2项前瞻性研究结果显示, 对于EGFR-WT患者, 二线使用化疗仍然优于TKI[21, 22]。2013年美国临床肿瘤协会年会上1篇Meta分析亦有此结论[27]。
维持治疗的2项研究SATURN与INFORM在WT亚组的结论相悖— — SATURN的结果支持WT亚组仍能从TKI治疗中获益, 而INFORM则得出了阴性结果。这可能和双方不同的基因检测手段有关, 吴一龙等[23]发现, 传统的测序法检测EGFR突变相较于扩增受阻突变系统法存在接近30%的假阴性, 这部分本应分类为EGFR-MT的患者因检测手段的灵敏性偏低而分入EGFR-WT组, 从而对该亚组数据产生了影响。另一方面INFORM研究的WT亚组共49例, 这相对SATURN的388例则稍显单薄。将2项研究的数据综合分析, 结果提示WT组Erlotinib优于安慰剂, HR 0.79(95%CI 0.63~0.94)[28]。
综上所述, 在目前的临床实践中, EGFR-WT患者无论一线、二线、多线治疗, 都应选择化疗而非TKI。维持治疗方面, TKI优于安慰剂, 却未与化疗药物维持治疗进行对比, 这还需要进一步的研究。
虽然TKI对于EGFR-WT患者疗效逊于化疗, 但并不是所有的WT患者均对其不敏感, 仍有部分患者能够从TKI治疗中获益, 除了由于技术原因造成EGFR突变状态假阴性外, 还有可能存在其他预测因素可以预测TKI的疗效, 见表4。
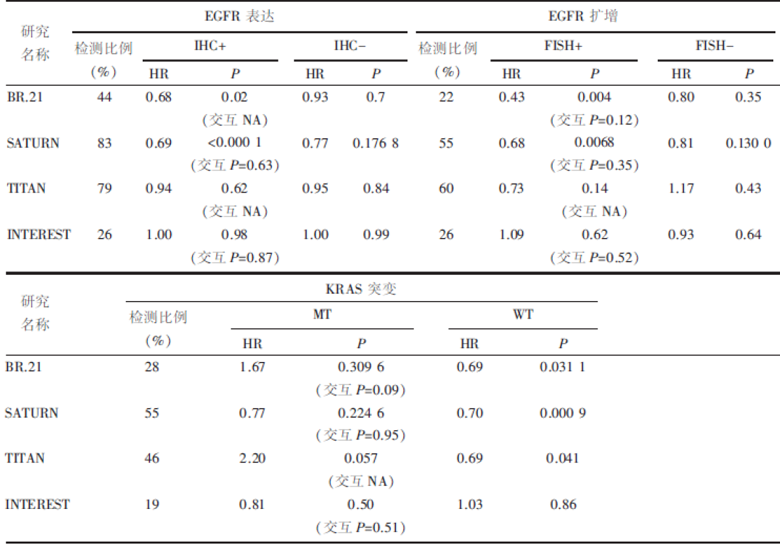
| 表4 预测因子 |
BR.21研究的数据分析中, EGFR表达阳性 [免疫组化法(immunological histological chemistry, IHC)]亚组的HR 0.68(95%CI 0.49~0.95), P=0.02, 提示可能从Erlotinib治疗中获益, 但交互分析P值未给出, 因此并不能确定该差异来源[15]。SATURN的后续数据分析亦发现EGFR表达阳性亚组能从TKI治疗中获益, HR 0.69(95%CI 0.58~0.82), P< 0.000 1, 但交互P=0.63, 提示EGFR表达与疗效的差异无关[29]。而TITAN和INTEREST研究关于EGFR表达的亚组分析均未得到任何阳性结果[18, 19]。2013年Maziè res等[30]对SATURN研究的数据再次分析, 结果提示无论是总人群还是EGFR-WT亚组, EGFR的表达情况均与TKI疗效无关。
这说明, EGFR表达阳性可能不是EGFR-WT人群TKI有效的一个预测指标, 但还需要更多的数据证实。
BR.21研究中, EGFR荧光原位杂交法(fluorescent in situ hybridization, FISH)阳性亚组HR 0.43, P=0.004, 提示可能从Erlotinib治疗获益, 但交互P值未达到显著标准, 为0.12[31]。SATURN结果相似, 而交互P值无差异[29]。TITAN和INTEREST的后续数据分析依然未得出阳性结果[18, 19]。Cappuzzo等[32]分析了102例NSCLC患者的病理标本, 发现EGFR高拷贝者比FISH阴性者更能从Gefitinib治疗中获益。
EGFR基因拷贝数的增加可能是一个潜在的WT亚组TKI疗效预测指标, 目前已有的数据还不能支持其应用于临床。
KRAS突变与EGFR基因突变几乎不共存, 这也导致在EGFR-WT人群中有相当比例的患者携带有KRAS突变。RAS的过度活化导致Raf/MAPK通路激活, 这是不依赖EGFR的一个信号通路, 可能导致RAS突变人群对EGFR-TKI耐药。但RAS活化同时增加EGFR配体TGF-α 的表达, 这也可能使得RAS突变患者对EGFR-TKI敏感[33]。
BR.21的研究数据中, 有15%的患者携带突变的KRAS基因, 但该亚组的HR未得出显著性差异(P=0.309 6), 交互分析P值稍稍大于显著性标准, 为0.09[31]。SATURN和INTEREST亦未得出阳性结果[18, 29]。值得注意的是, TITAN研究发现, KARS MT亚组HR2.20, P=0.057, 提示Erlotinib组有较高的死亡风险, KRAS WT亚组的HR为0.69, P=0.041, 提示该亚组使用Erlotinib降低了死亡风险, 交互分析由于样本量过小, 未能得出P值[19]。
几项研究的结论有些许不同, 但综合的趋势是KRAS突变的人群可能对TKI耐药, 而确定的结果同样需要继续研究。
Taguchi等[34]利用基质辅助激光解吸/电离质谱法分析患者用药前血清(后被称为血清VeriStrat测试), 将患者分为VSG组与VSP组, 观察到VSG组相较于VSP组对TKI敏感。随后Kuiper等[35]发现, 晚期NSCLC患者血清VeriStrat分型与Erlotinib联合Sorafenib(索拉非尼)的疗效有关, VSG亚组患者的OS和PFS均优于VSP亚组, HR分别是0.30(P=0.009)、0.40(P=0.035)。在2013年美国临床肿瘤学会年会上, 根据用药前血清VeriStrat分型使用TKI或化疗二线治疗EGFR-WT的前瞻性研究PROSE公布了结果, VSP亚组患者使用Erlotinib会承担更高的死亡风险, HR 1.72(95%CI 1.08~2.74), 而VSG亚组则没有显著性差异, HR 1.09(95%CI 0.79~1.50)[36]。这一前瞻性研究证实了2012年Carbone等[37]的结论。
BR.21在2010年又得出关于血清中EGFR配体双调蛋白和TGF-α 的水平的新数据。研究发现, 双调蛋白基线水平高的患者预后不佳, 但与Erlotinib的疗效预测无关。TGF-α 基线值与Erlotinib疗效有关, 在TGF-α 基线值低的人群中, HR 0.66, P< 0.001, 提示可从Erlotinib治疗中获益, 而在基线值高的人群中, HR 1.32, P=0.36, 交互分析P=0.04, 这说明TGF-α 基线值确与Erlotinib疗效有关, 基值较高者不宜使用TKI[38]。这点值得继续研究。
在诸多预测因子的试验分析中, 仅“ 血清VeriStrat分型” 这一因子进行了前瞻性的研究, 而结果只是一个EGFR-WT人群的TKI阴性预测, 即VSP亚组人群不宜使用TKI, VSG亚组人群使用TKI与化疗没有差异, 并没有筛选出EGFR-WT患者中适合使用TKI的人群。而其他可能的预测因子尚无前瞻性研究的数据, 并不能指导临床实践, 在1项包括BR.21和SATURN的Meta分析中, 研究者并未发现任何与TKI疗效相关的预测因子, 这与另一项包括BR.21和TRIBUTE的Meta分析结果一致[39, 40]。因此, 无证据表明存在EGFR-WT患者TKI的阳性预测因子。
目前的循证医学数据证明, EGFR-WT患者无论一线、二线、多线治疗, TKI单药均劣于化疗, 而TKI联合化疗疗效不优于单纯化疗, 且毒性增加。EGFR-WT患者的TKI维持治疗数据不足, 可能是一个备选的方案。目前尚无阳性预测因子能够筛选出EGFR-WT亚组中对TKI敏感的人群。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|