| 黄诚,主任医师,教授,福建省肿瘤医院肿瘤内科主任,福建医科大学肿瘤内科教研室主任,福建省肿瘤化学治疗质量控制中心主任。兼任中国抗癌协会肺癌专业委员会常委,中国癌症康复与姑息治疗专业委员会副主任委员。中国抗癌协会临床肿瘤学会常务委员、小细胞肺癌专家委员会副主任委员、血管靶向治疗专家委员会及生物标志物专家委员会委员。福建省肺癌专业委员会主任委员,福建省癌症康复与姑息治疗专业委员会主任委员,福建省肿瘤内科专业委员会主任委员;《中国肺癌杂志》,《临床肿瘤学杂志》,《中国肿瘤临床与康复》,《JTO》中文版等杂志编委。长期从事肿瘤内科的临床和科研工作,并且参加多项国际多中心临床研究项目,在省级以上核心刊物发表学术论文70多篇,获省级以上科技成果奖2项。 |
Zhang YX, Sheng J, Kang SY, et al. Patients with exon 19 deletion were associated with longer progression-free survival compared to those with L858R mutation after first-line EGFR-TKIs for advanced non-small cell lung cancer: A meta-analysis [J]. PLoS One, 2014, 9(9): e107161.
1a。
• 对于EGFR敏感突变的晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者, 一线使用表皮生长因子受体(epidermal growth factor receptor, EGFR)酪氨酸激酶抑制剂 (tyrosine kinase inhibitors, TKIs)的疗效优于传统化疗。
• EGFR-TKIs的疗效对两种常见EGFR突变类型(Del 19和L858R突变)的疗效是否有差异, 目前尚无定论。
比较EGFR-TKIs对19 Del和L858R突变NSCLC患者一线治疗的无进展生存期(progression-free survival, PFS)。
• 研究方法:Meta分析。
• 检索方法:数据库包括PubMed, EMBASE, Cochrane图书馆对照试验注册中心。关键词包括表皮生长因子受体(EGFR), 酪氨酸激酶抑制剂(TKI), 突变, 外显子, 非小细胞肺癌(NSCLC)。没有语言和发表时间限制。
• 入选标准:(1)Ⅲ B期或Ⅳ 期NSCLC患者接受一线单药EGFR-TKIs(厄洛替尼、吉非替尼、阿法替尼)治疗的随机对照研究(randomized controlled trial, RCT)或回顾性研究。(2)在NSCLC患者中根据EGFR突变类型(Del 19或L858R)进行亚组分析的RCT或回顾性研究。(3)可用肿瘤组织标本进行EGFR基因检测而不是血浆DNA检测。(4)手术复发的患者, 最后一次的新辅助化疗或者辅助化疗距离复发间隔6个月以上。(5)有EGFR-TKIs与化疗的PFS比较的风险比(hazard ratio, HR)的数据, 或有Del 19与L858R的PFS比较的HR的数据。
• 评价方法:
(1)合并分析:通过RevMan5.1软件进行, 合并PFS的HR及其95%可信区间(confidence interval, CI)。研究的异质性通过树状图和I2进行评估; 为避免潜在的异质性与错估标准差而在直接Meta分析与随后的间接比较中都使用了随机效应模型。
(2)质量控制:数据收集和评估的方法学质控按照QUORUM和Cochrane协作指南进行; 三位评价者用Jadad评分法对入选的RCT进行质控, 回顾性研究通过Newcastle-Ottawa量表评分法进行质控; 有争议之处经全体研究者讨论并达成一致。
• 干预措施:有EGFR突变的晚期NSCLC患者一线接受EGFR-TKIs治疗或化疗。
• 评价指标: PFS。
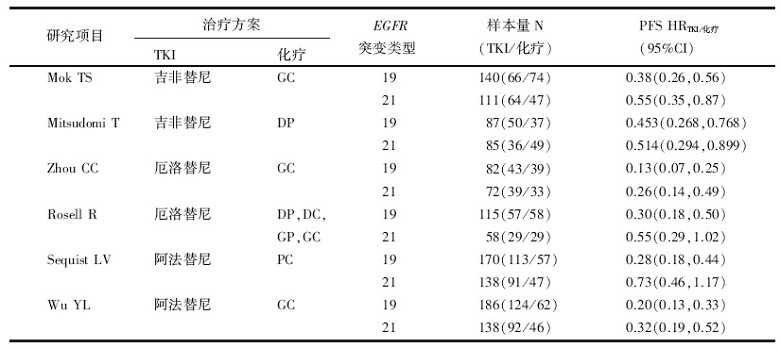
共纳入13项研究进行分析。其中6项Ⅲ 期RCT, 共1 382例晚期NSCLC患者, 接受一线EGFR-TKIs或传统含铂双药化疗, 提供了EGFR突变患者的亚组分析结果, 进行间接比较分析。其他7项回顾性研究, 共549例晚期NSCLC患者, 提供了EGFR 19 Del和L858R患者接受一线EGFR-TKIs治疗的直接比较数据, 进行直接比较分析。13项研究的主要特征见表1和表2。
| 表1 纳入间接比较的研究特征汇总 |
| 表2 纳入直接比较的研究特征汇总 |
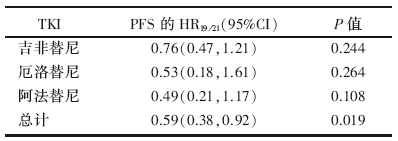
EGFR 19 del晚期NSCLC患者, 一线EGFR-TKIs对比化疗的中位PFS风险比HRTKI/化疗=0.28, 95%CI(0.20, 0.38), P< 0.001; EGFR L858R晚期NSCLC患者, 一线EGFR-TKIs对比化疗的中位PFS风险比HRTKI/化疗=0.47, 95%CI (0.35, 0.64), P< 0.001。间接比较的结果显示, EGFR 19 Del患者比L858R患者接受一线EGFR-TKIs治疗时PFS更长:HR19/21=0.29, 95%CI(0.38, 0.92), P=0.019。此外, 还对接受不同EGFR-TKIs治疗的EGFR 19 Del和L858R患者进行了亚组分析, 结果见表3, 亚组分析的结果与总体分析的结果一致。
| 表3 间接比较EGFR 19 Del和L858R患者使用EGFR-TKIs治疗PFS的HR |
直接比较的结果显示, EGFR 19 Del患者比L858R患者接受一线EGFR-TKIs治疗时PFS更长, HR19/21=0.75, 95%CI (0.65, 0.85), P< 0.001。
晚期非小细胞肺癌患者, EGFR 19 Del比L858R患者一线使用EGFR-TKIs的PFS更长。
随着EGFR-TKIs在EGFR活性突变NSCLC患者中的广泛应用, 以往一些单中心研究发现EGFR-TKIs 针对EGFR 19 Del患者的治疗疗效可能要优于L858R突变患者, 但也存在不一致的研究结果。随着相关治疗数据的积累, 应用Meta分析进一步探明这一现象也就应运而生。
本研究Meta分析设定了明确的纳入和排除标准, 最终纳入13项前瞻性或回顾性临床研究, 旨在比较Ⅲ B/Ⅳ 期不同EGFR突变类型(经组织标本检测证实19 Del或L858R突变)的NSCLC患者接受一线EGFR-TKIs单药治疗的疗效。该研究检索较为全面、资料选择过程可靠、统计方法较为恰当, 结果提示:(1)EGFR19Del的患者接受EGFR-TKIs治疗的PFS可能优于L858R; (2)无论是哪一种类型的EGFR活性突变, EGFR-TKIs的PFS均优于化疗。
该结果切实可信, 但研究也存在一些不足之处:(1)在间接Meta分析中, EGFR-TKIs与化疗的比较是建立在不同EGFR突变类型的化疗疗效相当的基础上, 但实际上一些研究表明不同EGFR突变状态的化疗疗效可能也有所差别(19 Del患者的化疗疗效高于L858R突变)[1], 这可能造成研究结果产生偏倚; (2)该研究中仅将PFS作为疗效评价的参数, 并未对总有效率进行分析, 如果结合PFS、总有效率两种数据, 可能结论会更有价值。
我们也注意到, 同期其他作者类似的研究也提示19 Del的患者接受EGFR-TKIs治疗的总有效率、PFS、总生存期可能均优于L858R突变患者[2], 但上述结论仍需进一步积累数据, 前瞻性队列研究有助于进一步明确回答上述问题。
随着EGFR突变类型的不断细化, 我们对靶向治疗的认识也不断深入。在今后的临床实践中, 我们不应仅仅满足于患者是否存在活性突变, 还需进一步关注突变类型, 而且在今后的临床试验研究中, EGFR突变亚型可能需要作为临床试验的必要分层因素。其次, 需要进一步从机制层面探明不同的EGFR突变类型的生物学行为有无不同, 包括致瘤活性、预后、EGFR-TKIs亲和力、耐药模式、化疗疗效的差别等等。另外, 值得强调的是, 虽然19 Del的患者接受EGFR-TKIs的PFS可能优于L858R突变, 但EGFR-TKIs的PFS均优于化疗, 因此, 无论是哪一种突变类型, EGFR活性突变患者给予EGFR-TKIs一线治疗地位仍未动摇。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|